文|MedTrend醫趨勢
7月27日,CDE連發三項指導原則,從“臨床試驗”的角度出發,貫穿設計-實施-評估全流程,正式開啟“以患者為中心”臨床試驗時代。

該指導原則僅代表藥品監管部門當前的觀點和認識,不具有強制性的法律約束力。相關內容將不斷完善與更新。(詳見閱讀原文)
文件提到,“以患者為中心”的藥物研發是指基于患者角度開展的藥物開發、設計、實施和決策的過程,旨在高效研發更符合患者需求的有臨床價值的藥物。
比如在患者招募環節,文件提出要基于患者需求的招募,應盡可能的讓有需求的受試者發現適合的臨床試驗,并保證基于潛在受試者的需求和最佳獲益-風險考慮而入組。并采用患者易于接受的知情同意方式等。
可見,臨床試驗全流程管理重塑正在加速進行中!
此外,本月初,針對前一段時間頻上熱搜的臨床試驗管理問題,國家局連發兩文:
先是NMPA發布《藥物臨床試驗機構監督檢查辦法(試行)(征求意見稿)》,規范和統一全國臨床試驗機構的日常監督檢查,被認為是劍指項目過多機構。
后是CFDI(國家藥監局核查中心)發布《藥物臨床試驗機構監督檢查要點和判定原則(征求意見稿)》,作為上述辦法的配套文件,充實細則。
兩份文件的發布,無疑為GCP(藥物臨床試驗質量管理規范)空白之處又補上一塊拼圖。
最近臨研圈的“爆火”,始于6月初,秦叔逵教授在《2023抗腫瘤創新藥物臨床研究論壇》上的“犀利”發言:
“我們國內大多數醫院臨床研究水平不夠,特別是有些省級腫瘤醫院。”
“每年看他(醫院)的年報,要接400到500項臨床試驗,接4-5項我都不敢用,不要說400項,這個問題可能很嚴重。”
“現在的臨床研究,不是數據造假,但因為醫生的不參加、不主導、不控制,臨床研究光靠CRC、CRA,總有一天會面臨臨床數據暴雷。”
"CRC都是小孩們,大專生或者本科生,都沒有受過嚴格的培訓,怎么知道臨床研究怎么做。"
“國家藥監局已經很頭疼這個事情,想再弄一次七二二風暴,像15年那時候,又怕挫傷大家的激情,不弄的話那些研究真的是質量堪憂。”
“巧合”的是,就在該發言傳出幾天后,業內就傳出一起臨床研究事故——一名CRC(臨床協調員)替代研究者開醫囑,藥物劑量遠超出正常,以致出現嚴重后果。
這正是秦教授擔憂的事情。
臨床研究是新藥上市的基石,非常嚴謹的科學,應由受過嚴格培訓的高水平人員親自負責,而時下紛紛擾擾,被詬病最多的隱患就是——臨床研究機構的研究負責人,受各種因素影響,不親自做研究,而是直接或間接指派CRC承擔診療任務。
一個現象的發生,根源一定是系統性問題。本文嘗試用三個方面解釋原因:
行業“劇震”后,生態變革,新藥研發需求猛增,臨床試驗需求旺盛;
高端臨研資源不足,PI臨床、科研工作難兼顧;
第三方SMO過快興起、內卷嚴重,又處于價值鏈底端,話語權最弱。
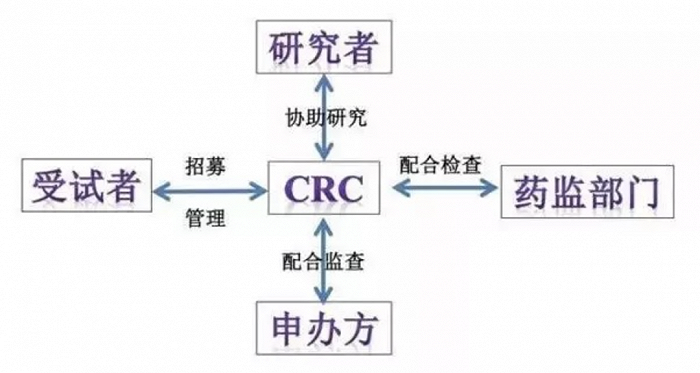
▲臨床試驗中各方職責及相互關系,來自:網絡
行業劇震后,創新藥“一夜成名”,臨床試驗需求激增
2023年4月,據Pharmaprojects數據顯示,中國目前共有5402條藥品管線,同比+23.22%,占全球管線數量的23.6%,排名全球第二。
如果以20年的長度來看,單純看管線數量,中國醫藥研發勢頭足以用“迅猛”來形容:
相比20年前,增長超20倍,
相比10年前,增長超6倍。
早已不是一個量級。
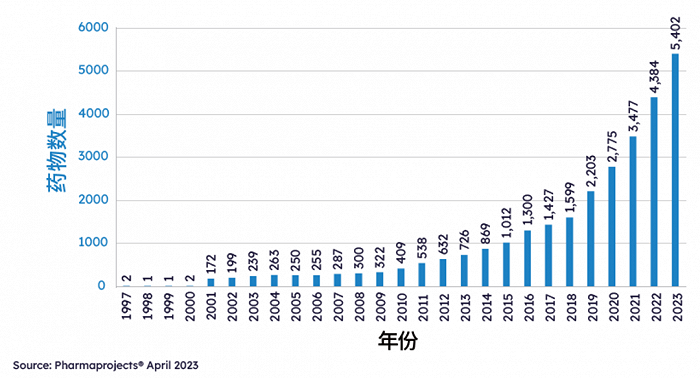
▲1997-2023年中國藥物管線規模
從新藥臨床試驗(IND)角度來看,2017年是個歷史轉折點。
2017年起,中國新藥IND數量猛然崛起,相比2016,國內藥企研發熱情大漲:
化藥,同比+84%,
生物藥,同比+178%。
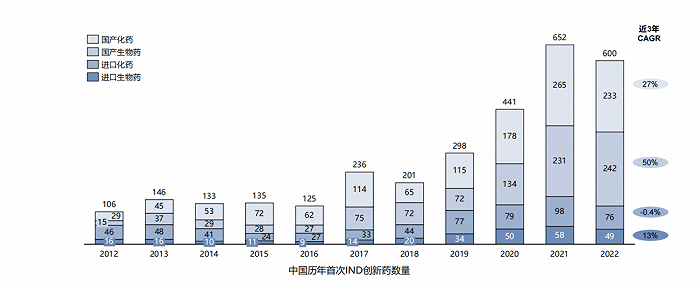
▲中國歷年首次IND創新藥數量,來自:醫藥魔方
這期間發生了什么?應該說是由一樁“慘案”引起。
2015年7月22日,CFDA發出臨床試驗數據核查公告,組織對已申報生產或進口的待審藥品開展臨床試驗數據自查核查工作。截止到該年底,總計1277個臨床研究主動撤回和不予批準,占比高達89.4%,被稱為“7.22風暴”。
2015年8月,國務院印發《關于改革藥品醫療器械審評審批制度的意見》,中國醫藥生態為之一新。
2017年10月,兩辦聯合印發《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,又稱“鼓勵創新36條”,激發起行業的創新熱情。
2018年,國內新藥上市申請(NDA)達57款,其中17款是國產,占比30%。要知道,往前數3年,這個數字只徘徊在15%左右。
直到2021年,藥審制度改革激活的熱情達到最高潮。
從臨床數據來看,2021年,國內IND申報的新藥數量達652件,同比+48%;國產化藥、生物藥都顯著高于進口。
這是本輪“寒冬”來臨之前,所有人都不愿錯過的創新藥財富效應,誕生了諸如國產PD-1的“澎湃潮水”,臨床試驗需求也不可收拾的由此爆發。
臨床、科研大山壓頂,PI“分身乏術”
猛增的臨床試驗自然會影響到生態,“722風暴”8年過后,中國醫藥市場碰到一個新問題:臨床試驗太多,研發資源不夠用了。
其實,中國能做臨床的醫院并不少,臨床試驗機構數量也在高速增長,但項目分配嚴重不均。就像“雞娃”效應一樣,大家都拼了命想擠進頂尖學校。
根據CDE公示數據,2022年上半年,頭部臨床試驗機構可謂“十分忙碌”:
四川大學華西醫院是開展臨床試驗最多的機構,項目數為173項,Ⅲ期臨床74項。
湖南省腫瘤醫院排名第二,156項。
河南省腫瘤醫院第三,155項。
華中科技大學同濟醫學院附屬協和醫院、吉林大學第一醫院分列4、5名。
前五家加總達到780項,占了總數(1125項)的69%。

▲2022年上半年最受歡迎的臨床試驗機構TOP 20,來自:戊戌數據
申報者(大多是藥企)對大三甲的趨之若鶩情有可原:
一是患者資源豐富,容易招募到各類藥物合適的受試者;
二與PI有直接關系,眾所周知,PI的“江湖地位”與新藥的影響力息息相關。
所以,根源不是醫院不夠用,而是PI的精力不夠用。
PI的工作從不輕松,臨床、科研、培訓都不能丟,幾座大山難以平衡,畢竟一天只有24小時。
有行業人士表示,也有PI對GCP不夠熟悉,不清楚自己的工作內容,過分依賴CRC執行臨床試驗。
當然,也不能排除如秦教授所說的情況——為了逐利不停地接項目——科研成果越多、發表文章數量越多、晉升便越快。
CRC壓力過大、利潤下滑,“非法行醫”或是逼不得已
有需求,就有供給。
為減輕研究者的壓力,提高臨床試驗效率和質量,CRC行業應運而生。SMO公司承擔CRC業務。
1、CRC的工作內容經PI授權,在臨床試驗中協助研究者進行非醫學判斷的相關事務性工作。具體包括:倫理委員會的聯絡、協助研究者完成知情同意、患者及其家屬的教育/聯絡/咨詢、臨床試驗的實施等。
2、國內SMO公司主要分為兩類:第一類是純粹的SMO,只有單一CRC業務;第二類是CRO公司單獨成立的SMO公司或子公司。
其實,CRC是“舶來品”,起源于上個世紀70年代,美國率先出現。
20世紀90年代,CRC最早出現在國內,和美國一樣,在CRC出現之前,各項臨床試驗具體操作均由臨床醫生及臨床護士兼職完成,需要投入大量的時間和精力。
此后直到2014年,以人力派遣為主要業務的SMO公司紛紛成立,也就是CRC的直接雇主,SMO 、CRC的數量逐漸增長。
2015年的“行業劇震”,讓中國臨床試驗研究者越來越意識到CRC的重要性,CRC在這之后瞬間興起,一度供需倒掛,熱門搶手。
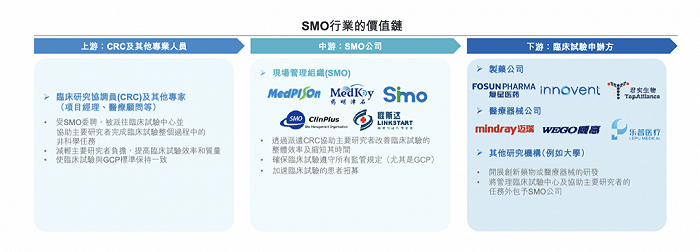
▲SMO行業價值鏈,來自:思派健康招股書
從市場規模來看,根據灼識咨詢報告,中國SMO市場規模發展迅速。
2015年為11億元,2020年達到53億元,年復合增長率為36.5%,以腫瘤藥物臨床研發需求為主。
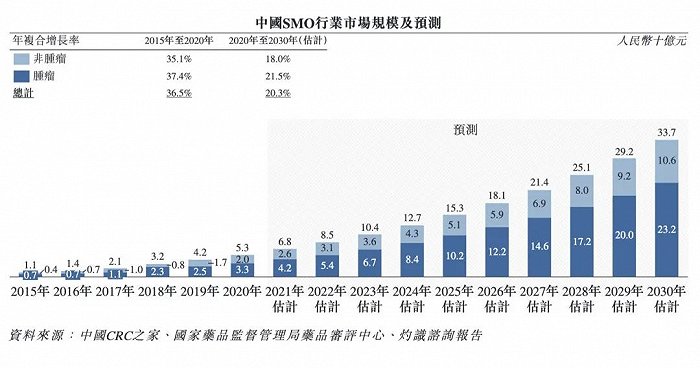
▲中國SMO行業市場規模及預測
企業數量方面,截至2020年10月,在中國CRC之家注冊的SMO有39家,還有眾多未注冊的中小型區域性SMO,對應CRC數量達到三四萬左右。
市場格局方面,中國SMO集中度不高,市場多由小規模公司占據。其中,前五大競爭公司共占整體市場份額的約30%-40%,包括津石藥業(藥明康德)、普蕊斯、聯斯達(康龍化成)、杭州思默(泰格醫藥)、比遜(思派健康)。
從“SMO第一股”普蕊斯經營情況來看,該行業利潤較為可觀,不算2020年的特殊影響,在2021年之前,都可以達到60%以上,甚至接近90%的凈利潤增長。
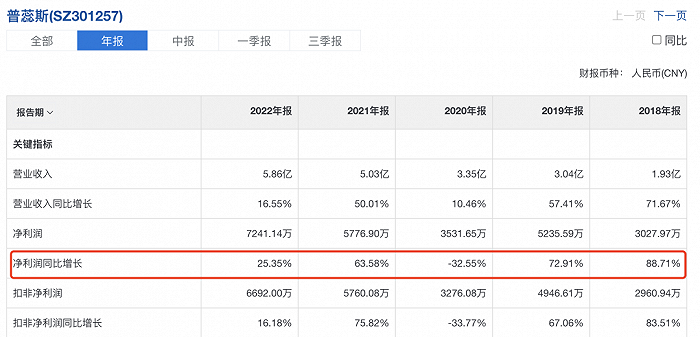
▲普蕊斯經營財報
然而,自2022年開始,情況不再樂觀。2022年上半年,普蕊斯實現營業總收入2.45億元,同比+9.09%;歸母凈利潤1942.57萬元,同比-28.93%,主要原因被歸為疫情。
實際上,還有公告沒提及的原因:
一是同質化競爭激烈,為了搶奪訂單,SMO服務價格不漲甚至下降。
二是隨著研發競爭的加劇,同等病例數的項目逐漸趨向于選擇更多中心,每個中心的單產降低,平均每病例的基礎成本增加。
再往深處看,是整體創新業研發熱情的收縮,經過國談以及資本降溫后,創新藥企紛紛“勒緊褲腰帶”,競標和比價流程都越來越嚴。簡單來說,“地主家”也沒余糧,服務方還能掙多少錢?
競爭弱勢讓SMO、CRC更加不敢“大聲喘氣”。
在不少CRC看來,自己身處食物鏈底端,扮演著“小秘書”的角色,沒有話語權,無法拒絕位高權重的PI,畢竟活兒總要有人去干。
6月13日,公眾號“晚安CRC”發布的一份千人樣本的網絡調查問卷結果顯示,
68%的CRC曾替PI開醫囑,
88%的CRC曾替PI寫試驗病歷,
42%的CRC曾替PI計算用藥劑量且無人復核,
82%的CRC曾經登錄PI的賬號隨機操作。
可悲的是,83%的CRC表示上述工作不可以不做。也就是沒有選擇。
監管不等人,開篇提到的管理辦法自發布之日起施行,一般性結果處理分為兩類:
對于處于及格邊緣的——綜合評定結論為“基本符合要求”的試驗機構或者試驗專業,視情形采取風險警示、告誡約談等措施;
對于存在風險隱患的——存在可能影響受試者安全或者試驗數據質量風險的,可以采取限期整改措施,通常為6個月。
監管的目的是督促試驗機構和研究者完善質量管理體系,雖然聲勢不比“7.22風暴”,但好在,隨著越來越多的關注,CRC這個新興行業正在逐步完善監管拼圖。


