文|未來跡FutureBeauty 林宇
“械字號”再起波瀾!
10月27日,國家藥品監督管理局醫療器械標準管理中心對外發布了《2022年第三次醫療器械分類界定結果匯總》(下稱《結果匯總》)。據了解,本次發布的文件涵蓋了今年7月至9月的醫療器械產品,分類界定結果共388個。
《結果匯總》中,對當下熱門醫美項目中所廣泛使用的醫美器械產品做了分類管理建議,超20款醫美器械產品的判定界限有所變動,其中最值得關注的是對醫用敷料的調整。
01 新增12款醫用敷料,被列入II、III類醫療器械管理
醫用敷料是一種常見的醫療器械,在醫療衛生領域起著重要的作用,已得到廣泛應用。它主要用于清潔覆蓋創面、吸收體內滲出液、為創面提供愈合環境,有些醫用敷料還可用于手術過程中支撐器官或組織。[1]
經《未來跡Future Beauty》梳理發現,此次被建議納入II類醫療器械管理的產品共計12款,其中10款為醫用敷料產品。其中,經常被用于激光/光子/果酸換膚/微整形手術后護理的“醫用海藻糖創面敷料”也在其中。
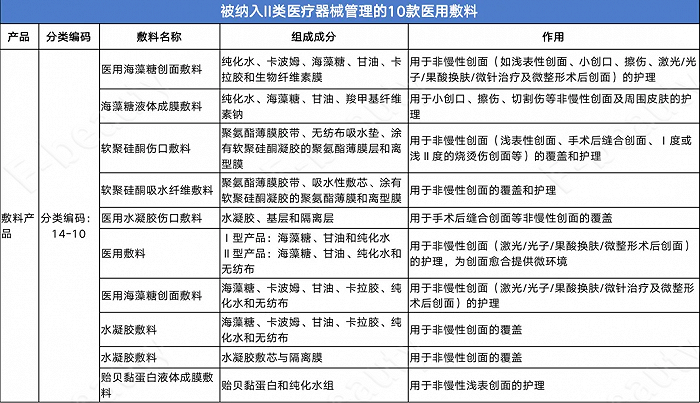
值得注意的是,用于激光、光子術后淺表創面和淺表非慢性創面護理的“醫用膠原蛋白敷料”被列入了III類醫療器械管理,但在組成成分中注明了該“膠原蛋白”指的是“動物源性原料”。這意味著,動物源膠原蛋白敷料被正式納入III類醫療器械管理。當下最熱門的利用合成生物技術生產的“重組膠原蛋白醫用敷料”是否也會被納入III類醫療器械管理目前尚不明確。

不過,在此前1-6月份藥監局發布的《結果匯總》中,已經將醫用重組膠原蛋白可吸收敷料納入了III類醫療器械的管轄范圍中。但其應用范圍明確界定為:用于下述疾病及由于創傷導致的全層皮膚缺損:(1)Ⅲ度燒傷、(2)外傷性皮膚缺損、(3)腫瘤或潰瘍、胎跡等切除后的皮膚缺損、(4)皮瓣去除部位等。

但目前市面上大量存在的“重組膠原蛋白敷料”主要用于激光、光子術后淺表創面和淺表非慢性創面護理;而與其功能相似的“醫用透明質酸鈉修復貼”則歸于二類醫療器械。
“應該不會以成分進行分類,因為還要考慮到其他的輔料和劑量上的問題。”襄陽楊四郎公司質量負責人柴振麗表示,“并且在法規公布之前,已經注冊過的產品有五年的注冊有效期,在這期間還可以繼續生產銷售,到期后才會受到管控。此外,廠家還有一個過渡期,打個比方,產品的注冊證書在八月份到期,八月份之前生產的東西還是可以進行售賣。”
按照我國現行的監管制度,在醫療器械的分級中:凡是用于慢性創面(各種原因形成的長期不愈合創面)、體內創面護理、具有潤滑防粘連、組織填充支撐等作用的醫用敷料,按照第Ⅲ類醫療器械管理;如僅用于皮膚淺表(真皮及以下)小擦傷、淺Ⅱ度燒燙傷,且組分不被人體吸收、不發揮藥理學作用,可按照第Ⅱ類醫療器械管理;如果僅用完整皮膚保濕或者具有去痘功能,則不作為醫療器械管理;如果僅通過在創面表面形成保護層,起物理屏障作用(如成膜且不對體表產生刺激)的醫用敷料,可作為第Ⅰ類醫療器械管理。[2]
從這個角度來說,僅用于激光、光子術后淺表創面和淺表非慢性創面護理的“醫用膠原蛋白敷料”被列入了III類醫療器械管理,顯然是被“升級”處理了。
不過,《未來跡Future Beauty》調研發現,動物源膠原蛋白由于存在攜帶病毒以及產生人體排異等風險的可能,因此世界各國均將動物源膠原蛋白在醫療領域的應用產品列入最高等級風險予以監控,甚至嚴格限制其進出口。[3]
我國將動物源膠原蛋白醫用敷料列入III類醫療器械管理,應該是意料之中的事情。《未來跡Future Beauty》在天貓搜索發現,目前在市面上銷售的主流“醫用膠原蛋白敷料”,比如巨子生物旗下的可復美、安德普泰旗下的芙清等品牌,均采用的是“重組膠原蛋白”,持有的是二類醫療器械證件;而采用動物源膠原蛋白的創爾生物旗下的創福康,則已經持有的是三類醫療器械證件。
02 “械字號”擦邊球被徹底堵死,監管進入“嚴上加嚴”時代
不難看出,“安全性”是醫療器械監管的核心指標。
2019年,國家衛生健康委員會官網發布了醫療器械安全管理的行業標準,根據醫療器械風險程度進行了詳細劃分,分為低風險、中風險和高風險,也就是《醫療器械監督管理條例》(以下簡稱《管理條例》)中的一類、二類和三類。
其中,一類醫療器械的管理較為寬松,常規控制即可;二類醫療器械則需要特殊控制;三類醫療器械存在較高潛在風險,必須嚴格控制。
醫療器械和美容化妝品行業的大面積交集出現在“面貼膜”市場。
此前,很多化妝品企業利用一類醫療器械相對寬松的監管,以“醫用冷敷貼”的名義申請了大量的一類醫療器械證號,并以“械字號面膜”的名義進行產品宣傳和銷售。但這股風潮很快被監管部門叫停。
國家藥監局先是在2020年初明確提出:“不存在‘械字號面膜’的概念,醫療器械產品也不能以‘面膜’作為其名稱。緊接著在2022年初修訂的《第一類醫療器械產品目錄》中,將醫用冷敷貼直接從目錄中進行了剔除,并要求相關產品在2022年4月1日前完成備案信息變更。
至此,只剩持有二類和三類醫療器械證號的“醫用敷料”,被允許在醫美或者微整形后使用。
“II類的申請門檻比I類的要高得多。”襄陽楊四郎公司質量負責人柴振麗告訴《未來跡Future Beauty》,“企業為一個產品申報注冊證需要的最短周期也要花費八個月到一年時間,提交申報資料、現場驗收、包括最后注冊證、生產許可證發放,都需要專業的指導,所以要支出大量的人力、物力和財力,一般的小型企業硬件和軟件都達不到要求。”
此外,根據國家發布的相關法規,二、三類醫療器械除了可以明確工作機理、生產工藝成熟,已上市的同品種醫療器械臨床應用多年且無嚴重不良事件記錄,不改變常規用途的,以及可以通過其他非臨床評價證明該醫療器械安全、有效的,可以免于提交臨床評價,而其余情況下的申請應當按規定進行臨床試驗。

而在實際的監管中,二、三類醫療器械的監管執行單位,也有很大的區別。
根據《管理條例》與《醫療器械注冊與備案管理辦法》,第一類醫療器械實行產品備案管理,備案人向設區的市級負責藥品監督管理的部門提交備案資料即可辦理。而二、三類醫療器械需要進行產品注冊管理,其中二類醫療器械由省、自治區、直轄市藥品監督管理部門進行審查,而三類則由國家藥品監督管理局審查,經各自部門批準后才發給醫療器械注冊證。

不光在生產和監管環節,在流通環節,二、三類醫療器械的要求也高很多。
《管理條例》規定,從事醫療器械經營活動,應當有與經營規模和經營場所和貯存條件,以及與經營的醫療器械相適應的質量管理制度和質量管理機構或人員。為保證產品安全性和有效性,對運輸、貯存、溫度、濕度等條件皆有要求。
而實際上,銷售一類醫療器械,一般只需要去工商局增加營業范圍就可以。但從事二類醫療器械經營的企業,需要向所在地設區的市級相關部門進行備案并提交上述相關資料。而從事三級醫療器械經營的企業不僅要提交相關資料,還需要向市級相關部門申請經營許可,相關部門需要對申請資料進行審查,必要時還會組織核查。從事二、三類醫療器械批發業務及第三類醫療器械零售業務的經營企業,還應當建立銷售記錄制度,包括產品名稱、型號、供貨者或購貨者名稱、地址等信息。

不僅如此,監管部門還不停地在法規方面修補漏洞,對醫療器械的監管正在進入“嚴上加嚴”的時代。
柴振麗告訴《未來跡Future Beauty》,在II類醫療器械分類目錄中,明確要求所含成分不被人體吸收,不含藥理作用。“之前沒有強調這句話的時候,有很多廠家打擦邊球,為醫療美容領域帶來很大的風險。”
而10月31日,國家市場監督管理總局等七部門聯合印發的《關于進一步規范明星廣告代言活動的指導意見》還規定,明星不得為醫療器械代言。
因“醫療器械”的產品宣稱能帶給消費者天然的安全感和吸引力,所以在過去,有很多品牌為自己加上“械字號”的標簽。“如果想做醫療器械,就乖乖地保證產品安全,把東西給做好。因為III類的規格比較高,普通人是做不了的。” 廣州荃智美膚生物科技研究院研發總監張太軍表示,“目的在于將一些打‘擦邊球’的產品的路給徹底堵死。”
03 秩序重建,部分醫用敷料可能會漲價
醫用敷料的江湖,越來越用秩序說話了。
《未來跡Future Beauty》觀察到,自2017年9月4日,國家藥監局正式發布新修訂的《醫療器械分類目錄》開始,國家藥監局每隔一段時間就會對醫療器械產品的分類界定結果進行匯總更新。


梳理發現,自2019年開始,諸多敷料類產品與具備醫美功效的注射類產品接連被納入III類醫療器械管控的范疇。
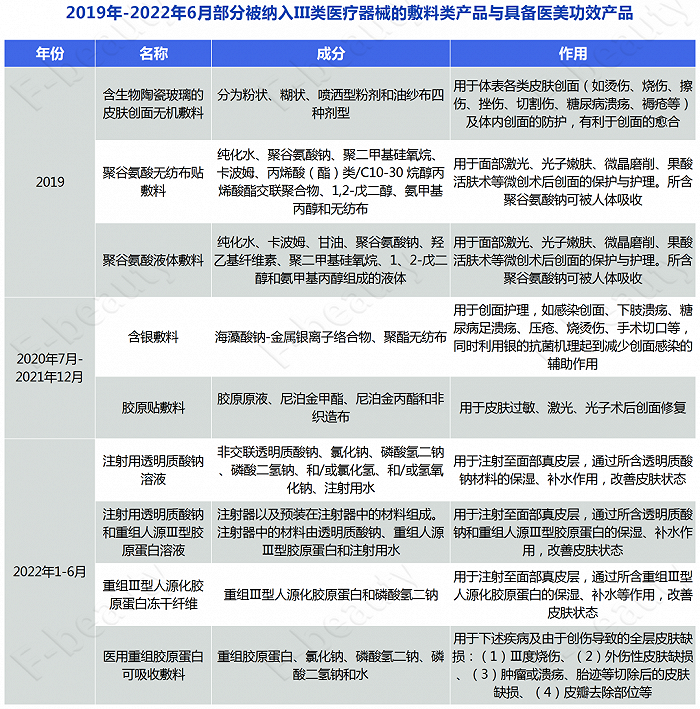
在2020至2021年年底這段時間,國家藥監局發布的《結果匯總》中,被新納入II類醫療器械管理的敷料類產品達25個,這一數量在2022年初截至今年9月,預計又將增加12個。

2020年1月至2021年12月部分醫用敷料產品截圖
此外,11月14日,藥監局也為目前市面上比較火的品類——醫用透明質酸鈉發布了產品管理類別的《公告》。

在《公告》中,將根據該類產品的不同用途進行分別管理,但按照醫療器械管理時,管理類別不得低于第二類。例如將醫用透明質酸鈉作為醫用敷料應用時,若產品可部分或者全部被人體吸收,或者用于慢性創面,按照第三類醫療器械管理;若產品不可被人體吸收且用于非慢性創面,按照第二類醫療器械管理。
目前市面上比較火的敷爾佳“白膜”“黑膜”,則被列入第二類醫療器械管理范圍。
除了透明質酸鈉外,今年4月,藥監局也對重組人源化膠原蛋白進行了醫療器械行業標準立項,這也標志著重組人源化膠原蛋白將迎來更具安全性、標準化的管理。

伴隨著對醫美類醫療器械的管控越發細致與嚴格,會給原先“掛羊頭賣狗肉”的廠家帶來巨大的沖擊與影響。與此同時,也將為消費者帶來更為安全、有效的醫用敷料產品。
“這一類的產品日后價格可能會上升。”張太軍告訴《未來跡Future Beauty》,他認為只是日常美容需求的話,沒有必要用到III類的醫用敷料產品,II類或普通面膜就能滿足需求。“一定要搞清楚醫用敷料和面膜之間的界限,不能把這個名稱搞壞了,國家不斷完善相關法律法規,也是有利于社會秩序的。”
柴振麗也表示,“實際上,有不少的化妝品企業不只做化妝品。在I類管控不嚴格的時期,很多都是做I類醫療器械的敷料產品,現在門檻拔高了很多,對企業的沖擊是很大的。”
科技的進步為化妝品行業帶來新的原料,新原料又會衍生為帶有新功效的產品。當產品密度在市面上達到一定程度,相關法律法規也會隨之完善,為人們提供一個更為清晰、細致的認知樣本。這個過程必然也會伴隨著市場的洗牌和重建。
本文部分參考資料:
[1]湯京龍、徐紅等,醫用敷料分類界定的初步研究,中國藥事2014年第28卷第9期
[2]徐向彩、余曉芬、鄭建、錢文文、梁澤偉,醫用敷料類醫療器械分類界定工作的研究,中國醫療器械信息,2022年1月:1006-6586(2022)01-0017-03
[3]陳泓馳、位曉娟等,魚膠原蛋白作為新型生物醫用材料的研究進展,中國修復重建外科雜志,2018年9月;32(9):1227-1230


