記者|張喬遇
近日,廣州必貝特醫藥股份有限公司(簡稱:必貝特)向科創板遞交的招股書獲受理,中信證券為保薦機構。
招股書顯示,必貝特是一家專注于創新藥自主研發的生物醫藥企業,聚焦于腫瘤、自身免疫性疾病、代謝性疾病等重大疾病領域,截至招股書簽署,公司未有上市產品。
公司最有潛力的一款核心產品BEBT-908有望成為國內治療r/r DLBCL三線患者的首個靶向治療小分子藥物,而該產品預計于2023年才能提交NDA申請,到實現商業化還很遙遠。不僅如此,BEBT-908還將面臨FDA審批政策方面的變動風險。
然而,報告期(2019年至2021年),必貝特已累計虧了約2.57億元,未來還只能依靠外部融資來維持研發和經營。
另需要指出的是,必貝特上市前一年內有30名股東突擊入股,存在股權轉讓價格低于增資價格的情況。

30名股東突擊入股
2001年至2012年,錢長庚在柯瑞斯公司(NASDAQ:CRIS)擔任副總裁,任職期間主導開發了BEBT-908,2012年2月,錢長庚從CURIS獲得其在中國的專利獨占許可,獨自歸國創業,出資200萬元創立了廣州必貝特醫藥技術有限公司(必貝特前身)。
截至發行前,錢長庚為公司實控人,合計控制必貝特43.96%的股份。必貝特共有50名股東,其中有30名均系申報前12個月新增股東。
界面新聞記者注意到,30名股東取得股權的時間集中于2021年7月、8月和11月。其中2021年7月、8月及11月股東增資價格均按照2021年7月增資投前估值33億元確定,增資價格為30.11元/注冊資本。
2021年11月,剩余部分通過股權轉讓入股的15名新增股東卻存在入股價格低于前次增資價格的情況。15名股東中除3名股東為代持還原外,6名股東入股價格為27.10元/注冊資本,6名股東的入股價格為25.60元/注冊資本。
值得注意的是,該次增資中部分股東還與必貝特、公司實控人存在對賭條款,各方約定了相應董事/監事推薦/委派權、優先認購權、優先受讓權、反稀釋權、共同出售權、平等待遇、關聯轉讓、股權回購等等特殊權利。截至發行前,超出《公司法》規定、義務方為公司或實控人的特殊權利條款及股權回購條款終止。
但部分條款未完全終止,倘若上市失敗,相關投資協議中的該等股權回購條款對控股股東/實際控制人及其一致行動人以及其他相關各方均恢復效力,義務方可能面臨回購風險。
前途未卜
發行前,必貝特還沒有產品獲批上市。2019年至2021年,公司營業收入分別為35.05萬元、37.69萬元和97.03萬元,主要依靠技術服務獲得零星收入。
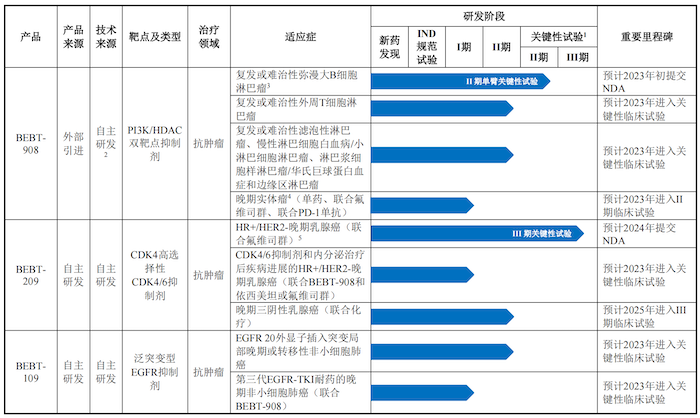
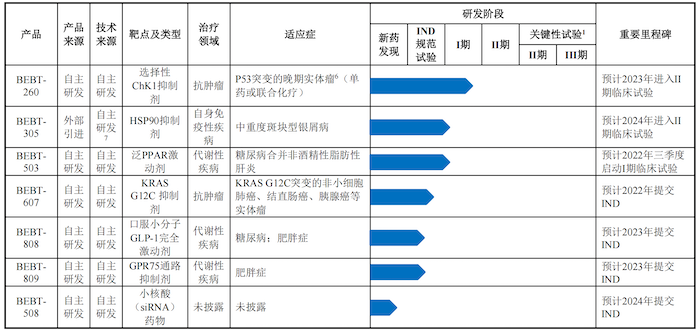
公司共有10款產品研發管線,其中6個自主研發的創新藥核心產品已處于臨床試驗階段或即將啟動臨床試驗。
目前必貝特最具競爭力的產品BEBT-908系針對PI3K和HDAC兩個靶點進行設計,選擇性抑制具有協同作用的腫瘤細胞信使核心蛋白激酶靶點PI3K和表觀遺傳調控靶點HDAC。
公司表示,BEBT-908與單靶點藥物相比具有更強的破壞腫瘤細胞信使網絡能力,并對腫瘤細胞有強大的協同殺傷作用,可克服單靶點藥物的固有或獲得性耐藥限制。
BEBT-908首個推進的適應癥為復發或難治性彌漫大B細胞淋巴瘤(r/r DLBCL),對象為三線患者。IIa期臨床研究結果顯示,BEBT-908在II期推薦劑量(22.5mg/m2)下的客觀緩解率(ORR)為50.0%,最常見(發生率>10%)的3級或以上的與藥物相關不良事件主要為血液毒性相關,包括血小板計數降低、中性粒細胞計數降低、淋巴細胞計數降低和白細胞計數降低。
截至2022年5月31日,BEBT-908治療r/r DLBCL的關鍵性臨床試驗入組82人,預計2023年初向國家藥品監督管理局(NMPA)提交新藥上市申請(NDA),有望成為國內治療r/r DLBCL三線患者的首個靶向治療小分子藥物。
除公司探索的小分子藥物在R/R DLBCL中的療效外,細胞免疫療法也成為近年來的研究熱點。
2021年9月,藥明巨諾靶向CD19的嵌合抗原受體T細胞(CAR-T)藥物瑞基奧侖賽注射液獲批上市,成為中國第二款獲批的CAR-T產品,也是中國首款1類生物制品的CAR-T產品。
瑞基奧侖賽注射液用于治療經過二線或以上系統性治療后成人患者的復發或難治性大B細胞淋巴瘤,其中就包括了彌漫性大B細胞淋巴瘤非特指型。
瑞基奧侖賽注射液在58例可評估有效性的患者中,客觀緩解率(ORR)為77.6%,不良事件方面,3級及以上CRS(細胞因子釋放綜合征)率為5.1%,NT毒性為5.1%。
需要指出的是,瑞基奧侖賽注射液掛網上市的公示價格為129萬元/支,每支體積約為5mL,而作為可能成為首個治療r/r DLBCL三線患者的首個靶向藥,BEBT-908又該定價多少?又有多少人有能力為其買單?
據招股書披露,必貝特BEBT-9082021年10月獲得了CDE“突破性治療藥物品種”認定資格。
值得注意的是,CDE對納入突破性治療藥物審評程序的品種會采取一系列支持政策,包括加強指導并促進藥物研發進程,優先處理相關溝通交流等。獲得“突破性療法認定”后會對藥品獲得“優先審評審批”進行優先安排,減少了創新藥物臨床申請的時間成本。
CDE官網顯示,截至7月12日,CDE官網共有111款藥品已被納入突破性治療品種名單。
但被納入突破性治療品種名單也并不意味著日后獲批上市能夠“一帆風順”。
界面新聞記者注意到,大連萬春醫藥(BYSI)注射用普那布林濃溶液曾同時獲得中美“突破性治療品種”認定,還被納入NMPA和FDA優先審評,并與恒瑞醫藥達成了14億元關于普那布林在大中華地區的聯合開發及獨家商業化權益的戰略合作。
但普那布林后續NDA申請卻遭到美國FDA駁回,第二天(2021年12月2日)萬春醫藥股價跌超60%,收于4.93美元/股,市值從當年11月29日5.09億美元跌破2億美元。之后便一蹶不振,最新一個月股價未超2元。
2021年1月,CDE同意BEBT-908治療復發難治彌漫大B細胞淋巴瘤可根據II期單臂臨床試驗結果提交附條件上市申請,
需要指出的是,PI3K抑制劑類藥物在血液惡性腫瘤領域的審批標準或將趨嚴。今年4月21日,FDA外部顧問組成的小組委員會以16票對0票(1票棄權)決定PI3K抑制劑類藥物需要隨機對照試驗來支持該類藥物在血液惡性腫瘤領域的批準。
今年1月,吉利德上市六年的PI3Kδ抑制劑Idelalisib撤出部分適應癥市場,Incyte宣布將撤回PI3Kδ抑制劑Parsaclisib在美國的新藥上市申請;2月,拜耳自動撤回了其PI3K抑制劑Copanlisib在中國的一項適應癥上市申請;3月,美國FDA打回MEIPharma的Zandelisib上市申請;4月,TGTherapeutics自愿撤回其Ukoniq(Umbralisib)聯合Ublituximab治療慢性淋巴細胞白血病和小淋巴細胞淋巴瘤成人患者的生物制劑許可申請/補充新藥申請。
除針對復發或難治彌漫大B細胞外,BEBT-908針對其他多種血液瘤適應癥已進入II期臨床試驗階段,產品為包含PI3K抑制劑的雙靶點藥物,未來是否受到影響還是未知數。
長期靠外部資金“供血”
在首款產品上市并成功實現商業化之前,缺少營業收入的必貝特還在持續虧損,2019年至2021年公司凈利潤分別為-5893.75萬元、-6126.00萬元和-1.37億元,三年累計虧了約2.57億元。
報告期公司研發費用分別為4815.92萬元、5911.75萬元和1.16億元,經營活動產生的現金流量凈額分別為-507.43萬元、-4190.27萬元和-1.01億元。
此外必貝特還進行股權激勵,2019年和2021年分別確認股份支付費用3051.08萬元和3479.58萬元。
界面新聞記者注意到,公司依靠股權融資方式獲得較為充裕的現金流,用來滿足持續增加的研發投入和其他日常經營支出。截至2021年,必貝特貨幣資金6.78億元。
公司報告期實收資本(或股本)金額分別為7891.00萬元、9863.75萬元和3.60億元;資本公積分別為3373.55萬元、2.27億元和2.46億元。
未來,必貝特還要燒錢多久?



