文|動脈新醫藥
醫藥產業的發展總是呈螺旋上升的狀態。在近兩年被生物藥侵占了大量的注意力的當下,小分子藥物需要一些新的技術手段助推,以迎來新的產業高潮。以PROTAC、分子膠為代表的蛋白降解技術在此時適時的出現,不僅掀起了小分子藥物的新風潮,同時也想外延伸到了更廣泛的制藥領域中。
基于此,蛋殼研究院撰寫了《靶向蛋白降解:小分子藥物的下一個黃金時代》,并將在報告中著重回答以下幾個問題:
1、小分子降解劑領域為何在近幾年得到復興?
2、關鍵技術點的發展成熟度如何?
3、有哪些國內外的企業已經準備好了在這個領域中大展拳腳?

4、哪些先頭產品在這波浪潮中占據了先機?
5、資本該如何保持清醒的頭腦判斷產業的未來發展?
為了弄清上述問題,蛋殼研究院在產業內進行了廣泛的調研,并結合自己的研究內容,試圖從行業概述、技術路徑、發展機遇與挑戰、未來趨勢研判等維度全面解析蛋白降解領域,以期為行業關注者及參與者提供有價值的行業信息。
01 行業概述:小分子藥物的下一個黃金時代
靶向蛋白降解是小分子藥物的最前沿突破。生物醫藥從大分子創新藥(單抗、雙抗、ADC等)、細胞治療(CAR-T等)、核酸藥物、基因治療、小分子蛋白降解一路走來,新的成藥機制不斷浮現。技術平臺的革新使得新的藥物有望克服原有成藥機制的瓶頸,也不斷延伸出新的挑戰,最終創造出具有優異臨床療效的新藥。
蛋白靶向降解利用人體內天然存在的兩大蛋白降解系統:蛋白酶體系統和溶酶體系統實現對致病蛋白的高效精準降解。基于這兩大蛋白降解系統,現有多種技術路徑開展相關研究并進入臨床,最為人所熟知的是PROTAC和分子膠。

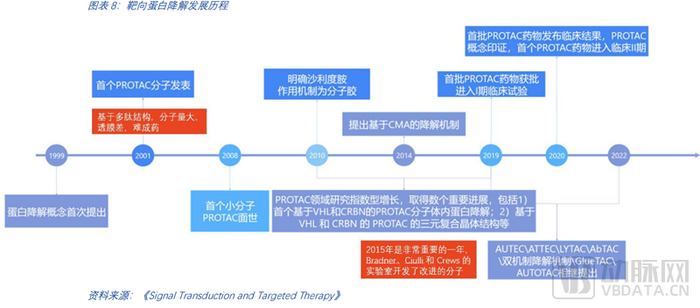
如今,PROTAC已從科研過度到理性設計,進入后概念驗證時代。其他技術路徑尚處于前期探索階段。以PROTAC為代表的小分子蛋白降解發展歷程已有超過20年的時間。蛋白降解概念的首次提出始于1999年,隨后在2015年的早期臨床前工作開發了改進的分子,這是里程式的重要進展。2019年開啟了首個臨床試驗。
02 行業優勢:理想的抗癌藥成藥方式
蛋白降解賽道中,隨著基礎研究和臨床試驗的不斷推進,PROTAC已表現出極大的商業價值。PROTAC有三大優勢,一是有望克服耐藥,二是有望將“不可成藥”變為“成藥”,三是有望成為“同類最佳”,是理想的抗癌藥成藥方式。PROTAC在世界各地被廣泛探索,這些降解劑潛在適應癥分布廣泛,在對抗癌癥疾病中表現出色,在對抗免疫性疾病、病毒感染和神經退行性疾病中也有所表現。
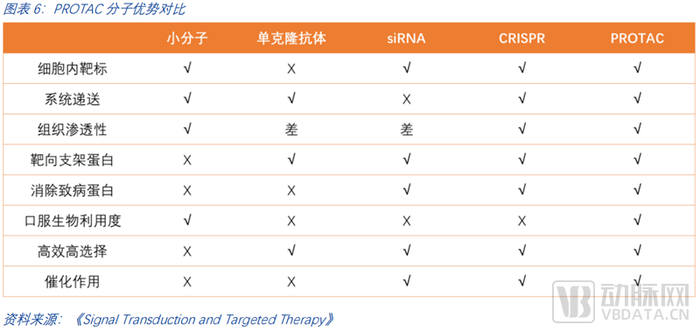
除了以上三大最顯著的優勢外,PROTAC橫向對比其他藥物類型,如單抗、核酸藥物、DNA藥物等,也有顯著的綜合優越性。一是PROTAC利用蛋白酶體系統從而降解細胞內靶標,而單克隆抗體則難以靶向細胞內的靶標; 二是PROTAC可系統遞送,RNA藥物的遞送仍然存在問題;三是PROTAC有一定的組織滲透性;四是它能夠靶向支架蛋白,從而對腫瘤的轉移等抑制效果更好;五是它能夠清除致病蛋白,傳統的小分子藥物僅能夠抑制蛋白質的活性;六是PROTAC可口服,潛在提升了病人的依從度和藥物的可及性,降低了用藥的痛苦;七是PROTAC具備高效選擇性。PROTAC的泛素化反應需要靶蛋白與E3連接酶保持穩定,這提高了對蛋白的精準選擇。例如,多激酶抑制劑Foretinib,可對100余種激酶具有較強的抑制活性(選擇性差),而基于Foretinib的PROTAC分子可結合54種激酶(選擇性有所提高),但最終僅降解<15種激酶(選擇性大幅提高)。潛在的高選擇性降低了藥物的毒副作用,患者的耐受力將大幅提升。八是PROATC具備一定的催化作用,其PROTAC分子可反復循環使用,這意味著小劑量即有潛力實現較好的降解效果,降低潛在由藥物劑量累積導致的毒副作用。
03 行業挑戰:三聯構象成藥難度重重
PROTAC也同樣存在待解決的挑戰。首先是藥代和藥效未明。由于PROTAC以催化模式發揮作用,傳統方法無法準確評估PROTAC的藥代動力學(PK)和藥效學(PD)特性。盡管PROTAC有大量的體外和嚙齒動物PK數據可用,但更高的物種和人類PK數據非常稀缺。因此,需要更多的研究,尤其是構建更高等的動物實驗數據庫,來建立PROTACs的PK和PD評價體系,從而以致構建更好的口服體內預測模型。進入人體后,與任何外源分子一樣,PROTACs第一個挑戰是穿過細胞膜。PROTAC的分子量和氫鍵供體及受體的數量往往比抑制劑的高,多出來的這部分可以理解為來自連接子和配體。滲透入細胞需要與流出做競爭(這也是許多大分子的常見問題),因此分子特性和細胞滲透也是一個重要的研究領域。雖然有穿越細胞膜的第一重挑戰,但許多PROTAC分子能夠進入細胞并達到足夠濃度,從而有效地達成預期的活動和功能。
PROTAC有三個組成部分,目標蛋白配體、連接子和E3配體。而三聯體成藥性差,分子量大,透膜性差,并不能很好的符合類藥五個原則。高效的三聯體篩選方法也存在缺失。三聯體的三個部分每個部分的變化互相排列組合,就成為了PROTAC庫,具備所有組合的可能性。
E3配體、蛋白配體和連接子的變體越多,PROTAC的合成就越困難。這在實踐中是一項巨大的工程。經過10多年的積累,科學界和工業界已經開發出數千種PROTAC分子。2020年,浙江大學侯廷軍教授課題組建立了首個線上PROTACs數據庫(PROTAC-DB)。截至2021年4月,該數據庫包含200多個靶點,共有2258個PROTACs,275個蛋白配體,68個E3配體和1099個連接子。相比之下,現有E3數量極少,在臨床中使用的E3更少(僅有VHL和CRBN)。人體中有超過600種E3,如何拓寬E3在PROTAC設計中的應用也是需要進一步探索的課題。
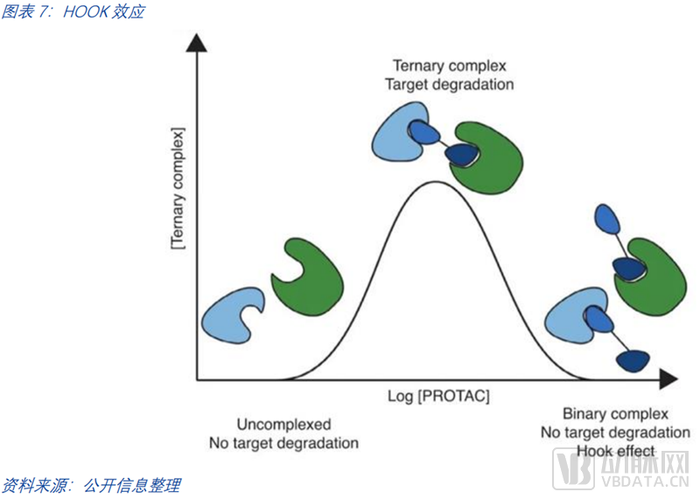
PROTAC的挑戰除了其分子自身,在降解過程中也有許多需要實踐探知的細節。盡管PROTAC領域取得了許多關鍵進展,但降解過程、降解靶向性、脫靶效應的理解仍不算全面。在降解過程中,三元復合體的形成也存在困難,PROTAC分子濃度較高時會產生HOOK效應,PROTACs會同靶蛋白和E3酶分別形成復合物,而無法與靶蛋白和E3酶一起形成三元復合物。
04 技術梳理:E3連接酶配體是PROTACs的關鍵
構建PROTAC的三要素分別為E3配體,連接子和蛋白配體。
E3連接酶配體是PROTACs最關鍵的構成部分。大多數PROTAC仍然使用CRBN或VHL作為E3連接酶。CRBN配體常用的有三類。一是基于泊馬度胺的配體,二是基于4-羥基酞胺的配體,三是基于來那度胺的配體。由PROTAC-DB數據統計,截至2021年PROTAC化合物中使用的各種CRBN配體頻率如下圖所示。

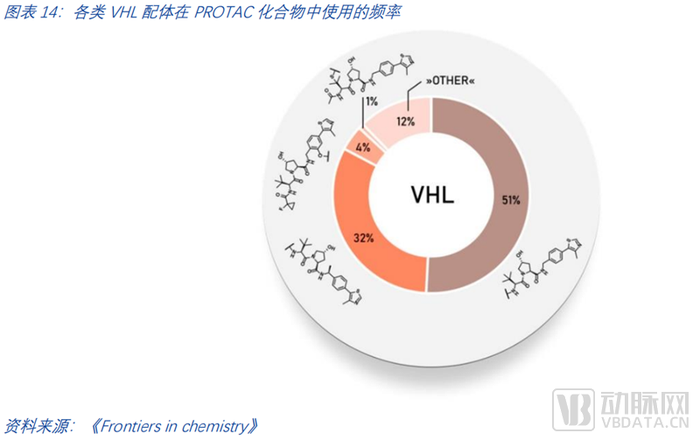
由PROTAC-DB數據統計,截至2021年,PROTAC化合物中使用的各種VHL配體的頻率如下圖所示。
蛋白配體在PROTAC分子中用于結合目標蛋白。該配體需要與目標蛋白有一定親和力,因此現在多數配體采用了目標蛋白的小分子抑制劑。特別的是,配體對目標蛋白的親和力要求并不高,結合力較弱的PROTACs仍可以對目標蛋白有較高的降解效率。
連接子的功能是連接E3配體和目標蛋白配體。連接子的設計會影響到E3:PROTAC:目標蛋白的穩定性,從而影響目標蛋白的降解效率。常用的連接子有PEG等。連接子的長度、連接子與配體的結合位點以及連接子的化學結構等對PROTAC降解效率有所影響。通過結構生物學和計算研究可以幫助更合理的設計PROTAC,但連接子的設計、合成目前缺乏指導設計的理論依據。對連接子的構建仍任務繁重。
05 行業格局:近半國內企業18年前后進入賽道
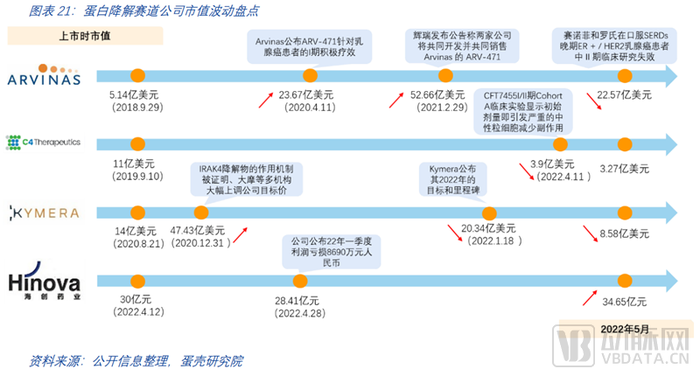
國內約有20余家企業開發布局PROTAC,近半國內企業18年前后進入賽道。海創藥業是PROTAC賽道上的代表企業并于近期上市。海外有眾多企業布局PROTAC,Arvinas、C4、Kymera是處于第一梯隊的代表性企業,均已上市。
從國內布局PROTAC的公司分布可以發現,大多中小企業成立于2017-2018年,這也是PROTAC領域研究指數級增長的年份。隨后即2019年,第一款PROTAC藥物ARV-110進入了臨床。如今,國內的大藥企也逐漸著手布局PROTAC技術,百濟神州、恒瑞醫藥等皆有布局PROTAC賽道。海外有諸多中小企業專注或重點布局在PROTAC賽道,現已有多家上市企業。近十家大型藥企如拜耳等前后布局PROTAC賽道。
如何評價一家蛋白降解公司?靶向蛋白降解賽道上的公司旗下最領先的臨床管線在臨床I/II期(參考后文管線全覽),現階段各個公司的策略不盡相同,體現在科學風險和商業風險的考量。科學風險上,回顧蛋白降解的“事件驅動”,需要一個特定的化合物去泛素化標記目標蛋白,這涉及到三點:一是通路和靶點的選擇(有充分驗證或者不充分的甚至全新的),這意味著風險的不同;二是基于選定靶點下技術路徑的選擇,各技術路徑的技術成熟度差異分化大,需要考量基礎研究的進展(論文、專利等等);三是既定技術路線下的公司人才儲備,像蛋白降解幾個成藥難點,涉及到對E3的理解,連接子的構建等等,有沒有相關的技術平臺能夠系統化的完成篩選合成,團隊的執行力和資源配置等等。商業風險上,適應癥是什么,是否作為末線治療方案,對商業價值會有很大的影響。
蛋殼研究院簡要盤點了蛋白降解領域的頭部公司,盡管靶點選擇、路徑選擇皆有不同,但基本都擁有自己的藥物開發平臺,可系統性的篩選和合成化合物,且平臺的立足重點是E3連接酶。
Arvinas是蛋白降解領域當之無愧的領頭者。Arvinas成立于2013年,創始人是PROTAC的概念提出者耶魯大學Craig M. Crews教授。目前布局的靶點較保守,兩款首批進入臨床的藥物其靶點(雌激素受體ER和雄激素受體AR),均已有高程度的驗證。Arvinas通過與其他公司合作研發藥物管線。Arvinas已同數家藥企巨頭達成合作,如輝瑞、基因泰克、默沙東等。
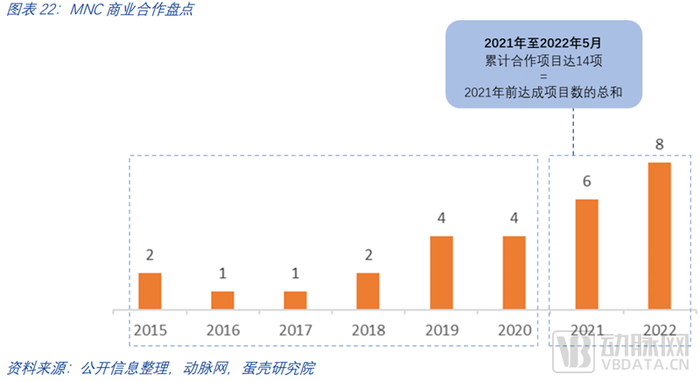
截止至2022年5月,各大國際藥企與頭部TPD公司已經達成多個上億美元級別合作項目,合作的深度和費用體量都體現了大藥企對此賽道的持續看好。跨國大藥企(MNC)們在蛋白降解領域的布局早在2015年就已經開始,但賽道的火熱起始自2021年。
2021年至今MNC在蛋白降解賽道達成的合作項目達14項,是2021年前達成項目數的總和。僅過去一年,合作項目披露金額超60億美金,合作數量平均每月一項。藥企投資合作的標的也從賽道中的幾家代表性頭部企業擴張到更多有特色專研于細分方向的初創企業。
截至2022年5月不完全統計,全球共有臨床階段蛋白降解藥物約31個。從進入臨床的靶標來看,集中度很高。靶點的選擇上多在有臨床驗證的靶點,策略較為穩健。管線布局研發方式中,以創新藥公司自研為主,大藥企合作為主的方式布局。

06 技術趨勢:從定義更適合降解的靶點出發
靶向蛋白降解未來20年將會如何發展?PROTAC概念的提出者Craig Crews給出了四個方向。一是定義和闡釋臨床上最合適降解的靶點類型,二是擴大E3連接酶的圖譜以實現精準治療,三是延展腫瘤以外的疾病治療;四是臨床驗證分子膠和PROTAC以外的蛋白降解方式。
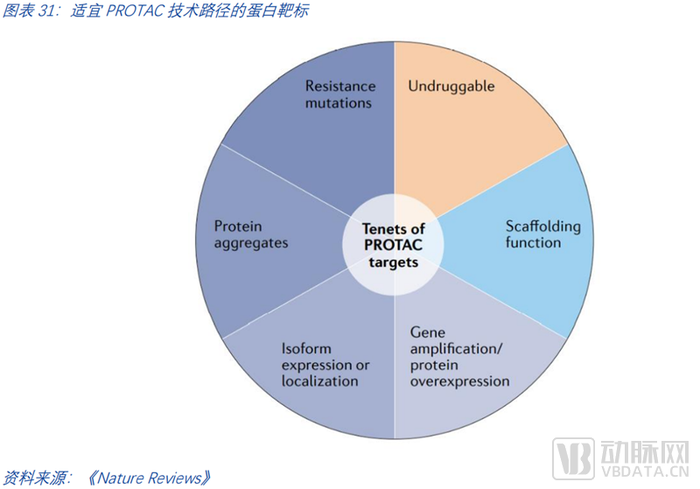
找到最合適的靶點們。合適PROTAC的靶點畫像具備的特征可以分為四類。第一類特征是“不可成藥”。如前文所述,第一波降解劑的浪潮是那些經典的可成藥靶點,在臨床中已有充分驗證。這些靶點的“PROTAC化”很好的驗證了PROTAC模式的有效性,和潛在的優越性(從現在的讓蛋白降解和此前的僅是抑制蛋白功能)。而最具前景的未來是在于那些現有技術路徑難以成藥的靶點。第二類特征蛋白表達偏離自然狀態,如過度表達、突變、聚集、異構體表達等等。第三類特征是支架蛋白。第四類特征是該靶點對現有療法已產生了耐藥性。
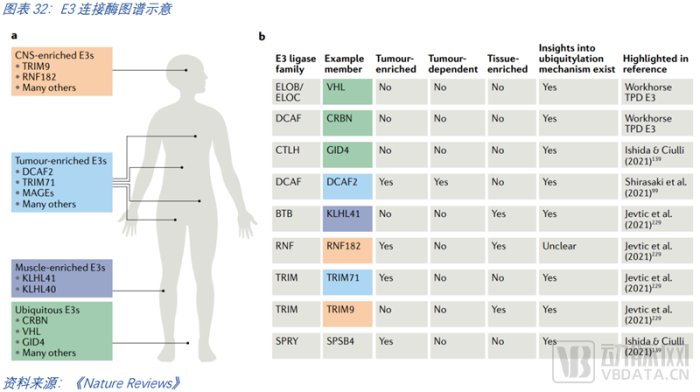
擴大E3連接酶的圖譜。擴增可用的E3連接酶是必然發展的趨勢,人體有超過600種E3連接酶,而在臨床上使用的僅2種(CRBN和VHL),常用的僅五六種。新的E3出現是一個何時出現,而非會不會出現的問題。從特異性的角度來說,E3連接酶也可以分為幾類。一是應用廣泛的連接酶,然而降解效率卻有所不同,基于連接酶的結構特征,可以找到更適用于PROTAC的連接酶。二是特異性的連接酶,許多連接酶有組織和細胞特異性,其在腫瘤中或許富集、或許必不可少,如能找到此類連接酶,則有望實現對腫瘤的精準治療。三是高富集的連接酶,此類連接酶的優勢在于腫瘤細胞難以通過連接酶的突變從而對PROTAC分子藥物產生耐藥性。但這種方式臨床是否真的有效仍需驗證。
延展腫瘤以外的疾病治療。適應癥發展方向可以分為三類,首先是炎癥免疫方向,二是神經疾病和神經退行性疾病方向,三是抗病毒方向。前文(4.2適應癥分布)已羅列了各個發展方向的前沿進展,隨著研究和臨床的推進,更多適合以蛋白降解方式成藥治療的適應癥將浮出水面。
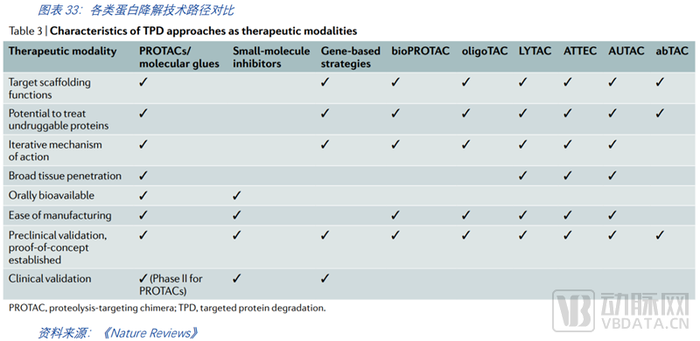
拓展蛋白降解模式。盡管PROTACs有望成為某些具備特定特征蛋白降解的重要方式,但有些蛋白并不具備這種方法所需的小分子結合位點。即便如此,這些目標仍然可以被其他的類PROTAC方法降解,包括生物PROTACs和混合PROTACs。還有其他類別的異功能分子值得探索,這些分子利用溶酶體而非泛素-蛋白酶體機制來降解目標蛋白,其中每一種都有不同于其他TPD模式和小分子抑制劑的特點。以PROTAC和分子膠為代表的泛素-蛋白酶體途徑主要作用于胞內蛋白,因此膜蛋白及分泌蛋白的降解仍需要更進一步的探索和臨床驗證。
07 資本趨勢:22/23年的臨床至關重要
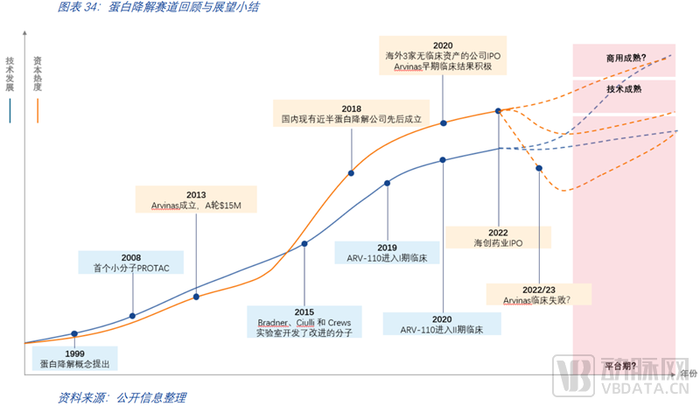
2015年以前,靶向蛋白降解并不為人所熟知,資本的參與也極弱。2015年改進的分子發布后,人們對蛋白降解的關注度迅速提升。無論是科研端還是產業端,都積聚了許多的資源投入在這個領域,許多蛋白降解公司如雨后春筍般快速崛起。回顧國內公司的布局情況,現有近半的優秀的小分子創新藥公司都是在2018年前后成立的。2020年,海外三家公司(C4、Kymera、Nurix)收獲了IPO,那時候這三家公司還均沒有臨床資產。2022年,國內的蛋白降解第一股海創藥業迎來了IPO。自2015年至今,蛋白領域的資本熱度已快于技術進展,這也為蛋白降解領域孵化了更多的優秀公司,助力更多的前沿技術更快推進。第一款藥物ARV-110正處于II期臨床中,可以預見的是,未來蛋白降解領域的發展將很大程度取決于首批藥物的臨床結果。無論走向如何,可以確定的是任何一個領域的巨大成功和它背后的顛覆式技術離不開多年的研究積累和無數的波折失敗。
同時,小分子的配套產業鏈已非常成熟,參與者少,競爭格局較好,相比其他創新藥領域高生產難度和白熱化競爭,蛋白降解的發展會更快更好。有時盡管細分的技術路徑不一定短期內取得巨大的進展,但過程中積累的Know-how將厚積薄發,爆發出驚人的力量。
過去的20年蛋白降解模式不斷沉淀積累孕育了巨大的疾病治療潛力,文末,讓我們一起期待蛋白降解的未來20年。



