文|青眼
5月20日,國家藥監局發布公開征求《關于醫用透明質酸鈉產品管理類別的公告》(修訂草案征求意見稿)(下稱“意見稿”)和修訂意見。其中明確了醫用透明質酸鈉作為醫用敷料應用時,若產品不可被人體吸收且用于非慢性創面,按照第二類醫療器械管理。由此,不少行業人士認為,這是給二類透明質酸鈉敷料“松綁”了。
最低二類,醫用透明質酸鈉敷料開放
2009年原國家食品藥品監督管理局發布《關于醫用透明質酸鈉產品管理類別的公告》(2009年第81號,以下簡稱81號公告),其中僅根據不同臨床用途(適應癥),將醫用透明質酸鈉產品按照了2種情形進行管理。

81號公告距今已有13年,這期間各類新產品不斷涌現,81號公告已不能完全滿足行業發展和監管需要。因此,此次意見稿正是對81號公告的修訂、補充。
據悉,此次意見稿根據不同預期用途(適應癥)、工作原理等,將醫用透明質酸鈉產品分為了“按照藥品管理”“按照不低于第二類醫療器械管理”“按藥械組合管理”3大類別,共計16種情形。這就意味著醫用透明質酸產品最低的合規門檻為第二類醫療器械。


其中,在“按不低于第二類醫療器械管理”中,共包含了11種情形。值得關注的是,意見稿明確指出,醫用透明質酸鈉作為醫用敷料應用時,若產品可部分或者全部被人體吸收,或者用于慢性創面,按照第三類醫療器械管理;若產品不可被人體吸收且用于非慢性創面,按照第二類醫療器械管理。

據青眼調查了解,雖然早已有二類透明質酸鈉敷料獲批,但僅是少數省份。因此,在不少業內人士看來,此次意見稿釋放出“國家對二類透明質酸鈉敷料產品松綁”的信號。
值得一提的是,意見稿還尤其強調,“以涂擦、噴灑或者其他類似方法,施用于皮膚等人體表面,以清潔、保護、修飾、美化為目的的日用化學工業產品,按照化妝品管理”。意在進一步劃清醫療器械與化妝品的界限。
華熙生物注冊事業群總監劉旭表示,意見稿的出臺,將會對醫用透明質酸鈉類產品有更明確的分類,申報注冊及市場管理都會更規范,有利于促進行業有序良性發展。“在本次修訂草案中,可以說把‘透明質酸’這一應用領域非常廣的成分,進一步進行了規范,也更符合當下的實際市場需求和監管趨勢。”
此外,意見稿中“作為注射到真皮層,主要通過所含透明質酸鈉的保濕、補水等作用,改善皮膚狀態應用時,按照第三類醫療器械管理。”這一規定,則被業內解讀為“水光針轉正”。
僅批了30個
眾所周知,此前“械字號面膜”在市場上十分泛濫,各種醫用冷敷貼、透明質酸鈉敷料等產品均打著“醫用面膜”的旗號橫行。不過,近年來,由于全國各地對于“械字號”產品的嚴管,上述現象已得到了遏制。青眼在各大電商平臺上搜索“透明質酸鈉 敷料”發現,相關商品大多持有二類醫療器械注冊證,一類產品已難尋蹤跡。
青眼以“透明質酸”為關鍵詞在國家藥監局境內醫療器械(備案歷史系統)中查詢,也僅顯示了6條記錄。
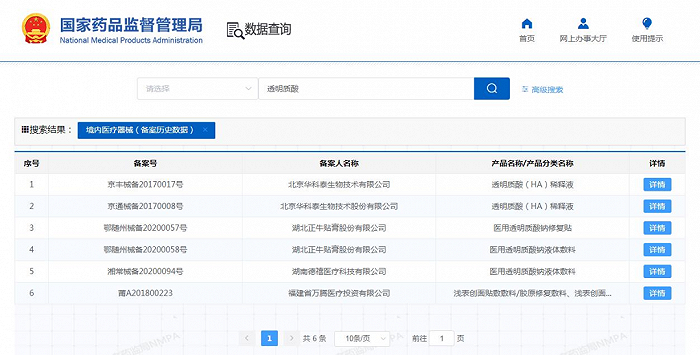
“一類透明質酸鈉敷料產品早就沒有人做了,大家現在都在做二類的,只是現在想拿到證并不容易。”湖南新諧康醫療器械有限公司合伙人俞志明向青眼介紹,由于二類透明質酸鈉敷料產品并不在《醫療器械分類目錄》(2017年版)里,所以很多省份不批,只有湖南、黑龍江等少數省份批了一部分產品。
事實確實如此,青眼以“透明質酸”為關鍵詞在國家藥監局境內醫療器械(注冊)中查詢,共顯示有180條記錄,這其中還包含了近50個三類產品以及“透明質酸檢測試劑盒”“醫用透明質酸鈉凝膠”“透明質酸鈉潤滑液”等產品。二類透明質酸鈉敷料(含修復貼)的產品僅約30款。
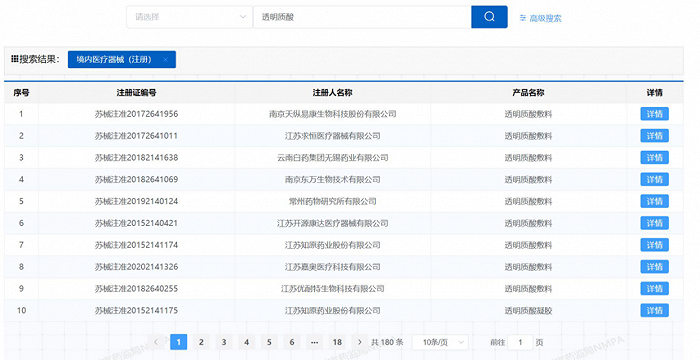
廣州昕生醫學材料有限公司總經理楊偉紅也表達了類似的觀點,“在二類透明質酸鈉敷料的審批上,各地的尺度都不一樣,譬如,廣東省到目前為止,就一個都沒批。若意見稿最后能落地,那就說明各地都可以放開了。”
不過一位不愿具名的業內人士則認為,“即便意見稿落地,也不等同于全面放開,管得嚴的省份還是會卡,除非是二類透明質酸鈉敷料寫進了《醫療器械分類目錄》。”該人士也表示,“整體形勢將要比目前‘松’一些。”
雖然,目前獲得二類透明質酸鈉敷料注冊證的產品不多,但是透明質酸鈉敷料的市場卻較為繁榮。在天貓平臺上以“透明質酸 敷料”為關鍵詞進行搜索,共顯示有1223件相關商品,銷量排名前三的產品的月銷量均超過了1萬件。
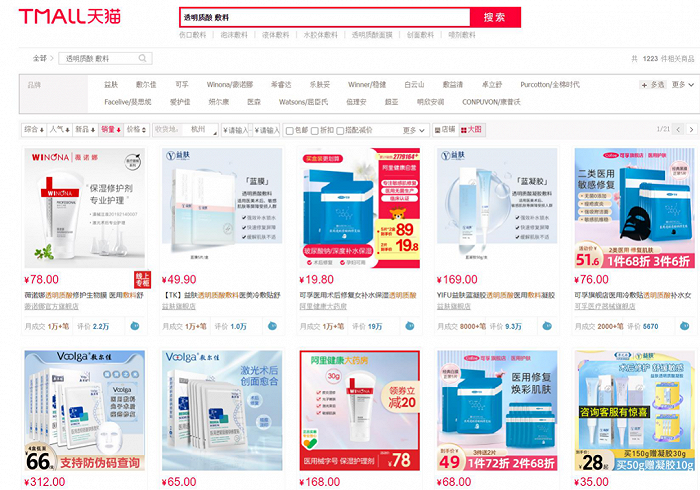
并且,敷爾佳還要借透明質酸鈉修復貼沖擊資本市場。根據敷爾佳招股書顯示,敷爾佳早在2014年研發出“醫用透明質酸鈉修復貼(二類)”,2020年該公司僅醫用透明質酸鈉修復貼的收入就超過8億元。然而,招股書顯示該公司的研發人員僅3人,也飽受爭議。
面膜市場將遭遇新一輪沖擊
目前透明質酸鈉(玻璃酸鈉)產品除了在藥品、醫療器械應用外,還常用于化妝品、食品等領域,部分產品用途介于藥品、醫療器械、化妝品邊緣。也是基于此現狀,國家藥監局對醫用透明質酸鈉進行重新歸類管理,明確醫用透明質酸鈉該怎么用、怎么管,將利于全國統一。
從醫用敷料市場來看,據弗若斯特沙利文報告顯示,中國醫用敷料的市場規模從2017年的67億元增至2021年的259億元,復合年增長率為40%,未來預計將從2022年的347億元進一步增至2027年的979億元,預計復合年增長率為23.1%。
據多位行業人士介紹,目前辦理二類透明質酸鈉敷料注冊證的成本約為20萬元左右。俞志明表示,公司已取得了2個透明質酸敷料的二類醫療器械注冊證,每個產品的獲證成本約為20萬元,一個產品需要花費1到2年的時間才能完成注冊。“這個成本并不包括廠房建設、前期研發等,僅是辦證過程所需的費用。如果加上廠房建設等投入,則需要400萬元左右。”
山東一位不愿具名的械字號廠家負責人也表示,不同的產品還需要臨床評價或臨床試驗,來驗證產品的安全性和有效性,需要大量的科研人員和技術資料來支持。“‘二、三類醫療器械’的分類不僅僅是對產品的標準,還意味著GMP標準車間、健全的質量管理體系、專業的人員參與運營,這是考驗企業的管理能力、研發能力、供應鏈能力和商業化能力,而這些能力也需要企業有持續性的投入。”
雖然二類透明質酸敷料具有一定的門檻,但前景可觀,想分一杯羹的企業在不斷增加。醫用敷料也逐漸蠶食了一部分面膜市場,進入到了價格戰階段。
“估計意見稿正式落地后,將會有更多的產品獲批。”楊偉紅也稱,從另一角度來看,這也可能會對面膜市場造成一定的擠壓。
由于前期受到了不正確的市場教育,在消費者心智中,敷料貼已經和面膜劃上了等號。因此,隨著二類透明質酸鈉敷料開放,也需警惕“醫美面膜”卷土重來,對化妝品行業造成二次傷害。



