文|青眼
5月1日,是多個化妝品新規過渡期的截止日。今日,國家藥監局針對行業較為關注的普通化妝品備案年度報告等問題,發布了化妝品監督管理常見問題解答(四),其中明確指出,對未按要求進行補充填報資料的產品,在完成補充填報之前,不得繼續生產、進口。同時,由監管部門取消備案的產品也不能再上市銷售。
值得注意的是,由于舊產品無人認領,近期江西省3個下轄市共計有231個產品取消備案,化妝品的大清洗開始了。
已有220萬條備案,清理“僵尸”產品
為什么普通化妝品要提交年報?國家藥監局指出,目前備案平臺已經形成逾220萬條備案產品信息,受新《化妝品監督管理條例》(下稱《條例》)及其他影響,有些雖然已經不再繼續生產,但產品信息依然在備案平臺上愈積愈多,逐步形成“僵尸”產品,給監管工作和社會公眾查詢都帶來了很大不便。加上有些產品甚至無法找到備案人,產品的質量安全主體責任無法落到實處,這些產品給消費者健康安全帶來隱患,亟待通過合法手段進行清理。
于是結合《條例》和《化妝品注冊備案管理辦法》(下稱《辦法》)規定,明確自2022年1月1日起,通過原注冊備案平臺和新注冊備案平臺備案的普通化妝品,統一實施年度報告制度。備案人應當于每年1月1日至3月31日期間,通過新注冊備案平臺,提交備案時間滿一年普通化妝品的年度報告。逾期者將被責令限期整改,限期內仍未整改者將被取消相關產品備案。

“此番系列新規的出臺,即取消從前‘收一次錢,終身VIP’的規則,而靠‘收取年費’來進行監督管理,預計再經過幾年年報的提交,就能逐步徹底清理‘僵尸’產品。”上海某檢測機構負責人比喻道,其實國家給的時間點是比較長的,也不否認企業在實際情況中存在著不同的困難而無法及時提交,但是在相關節點來臨前,企業確實應當優先把精力放在提交資料上。
值得一提的是,4月初,已先后有廣東省藥監局、浙江省藥監局和上海市藥監局發文稱,未完成年報的產品,備案人可在今年6月30日前完成整改,屆時逾期未完成者,將被依法予以處置。
對此,廣東柏亞化妝品有限公司研發總監施昌松表示,這是監管順應市場實際需求的解決方案,比較接地氣。前述檢測機構負責人也指出,目前全國80%的產能都集中在廣東省,確實存在例如檢測機構不足、各項程序來不及疏通等問題,所以廣東省優先提出增加3個月的緩沖期,“后續也會有更多其他地區跟進,給予企業更實質性的幫助。”
不補資料,不得生產、進口
針對“已注冊備案產品為何需要補充填報相關資料”的問題,國家藥監局指出,此前在舊平臺提交的注冊備案資料相對簡單,國產產品備案僅能查詢到產品配方成分信息和銷售包裝,其他相關資料均由企業存檔備查,由此造成了一些必要信息的缺失,所以需要對相關數據進行補充完善。
“主要是補充配方表全成分(含原料商品名和供應商信息、原料安全或者規格材料)、產品包裝信息文字版、功效證明摘要等。”針對當前企業補錄存在的難點問題,中山市立創質量管理有限公司副總經理李彬向青眼表示,主要難點在于:第一,目前配方表全成分跟以前的簡易配方有差異,新配方表成分跟包裝成分不一致,會導致包材的浪費;第二,原料安全資料、出廠檢驗報告、質量規格等相關材料很多,而原料供應商無法協助提供;第三,之前產品功效宣稱五花八門,如果每個功效都要提供證明材料成本很高。
施昌松也指出,目前補錄存在的主要問題是時間緊、內容多、政策變化大,且各地審核標準不一致,此外,還包括一些原料的報送信息提供不及時等,都會成為企業補錄信息的難點問題。
廣東尚品匯化妝品股份有限公司彩妝研發主任林麗雋則向青眼提出,注銷產品要跟品牌客戶方簽好雙邊協議,不然這邊注銷了,回頭品牌客戶方找過來說怎么賣不了,“對我們比較麻煩的就是要挨個聯系客戶,挨個產品去確認。”

值得關注的是,國家藥監局也特別強調,補充填報資料作為證明相關產品符合《條例》及其配套法規規定的必要條件,對未按要求進行補充填報資料的產品,在完成補充填報之前,不得繼續生產、進口。
“應該理解為5月1日前,需完成補充填報即可。”浙江中貿總經理舒婷婷告訴青眼,主要就是把原來的產品備案資料去補充下資料,對于企業來說,還是可以做到的,不過5月1日這個時間節點的事情也不少,包括上傳功效摘要和標簽管理辦法的時間節點都是5月1日。
李彬也表示,目前還未到截止時間,所以未補充填報的還能繼續生產和進口,但5月1日后,若還未補錄,則無法進行生產和進口。
“這次的過渡期要求補充的信息,其實就是按照新的條例和新的備案資料要求完善原來的備案信息,如果沒有及時補充,就是等于沒有備案,是非常正常的規范要求。”廣州新邦技術服務有限公司總經理曾廣頗指出,這項工作是一般企業都應該有能力做到的。
“當下,監管部門和生產企業之間確實還存在著認知差,所以國家希望通過更多的監管方式和工具來透徹地了解行業的實際情況。”前述檢測機構負責人表示,隨著監管渠道逐漸增多,監管力度也會逐漸增大,但是注銷并不是監管的目的,只是走到最后需要打出這最后一張牌,來不斷促進行業健康有序地發展。
231個產品要沒了
另外,在此次的解答中,國家藥監局表示,根據《條例》《辦法》和化妝品注冊備案相關法規規定,對不再生產、進口的產品,備案人可在備案平臺主動申請注銷。備案人主動注銷產品既有利于維護消費者的知情權,同時提高了監管部門效率。申請主動注銷的產品,如不存在違反法律法規的情形,備案信息注銷前已上市的相關產品,可以銷售至保質期結束。
而監管部門取消備案是對違法行為的懲罰措施,按照《條例》六十五條規定,備案部門取消備案的產品自取消備案之日起不得上市銷售、進口,仍然上市銷售、進口該產品的,監管部門將按照規定依法予以處罰。
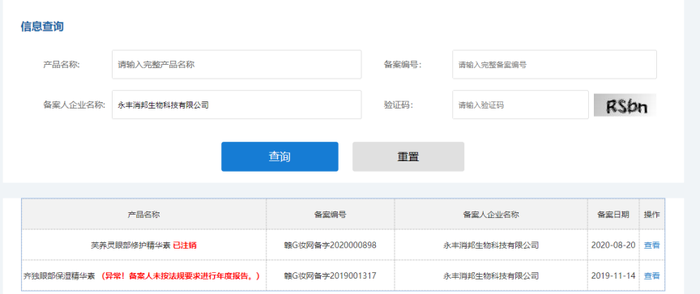
值得注意的是,近日,江西省下轄3個市(鷹潭、撫州、吉安)市場監督管理局陸續公示了一批擬取消普通化妝品備案名單,共涉及231款產品。在國產普通化妝品備案信息平臺上,青眼注意到,不少產品均顯示“異常,備案人未按照法規要求進行年度報告”。



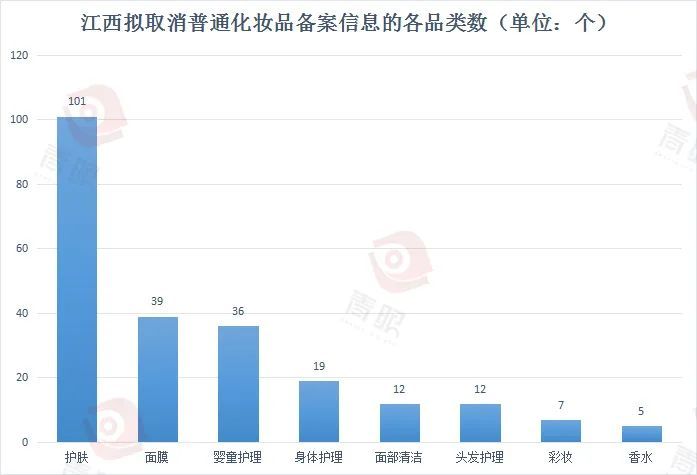
青眼統計發現,在擬取消備案信息的產品中,護膚品類占比最高,占比接近一半;其次是面膜類產品,共涉及39個產品;另外,嬰童產品共36款產品被取消備案。
按企業來看,青眼注意到,江西綠純電子商務有限公司、江西葆揚投資管理有限公司、吉安市爵麗美化妝品有限公司、吉安市記安長青生物科技有限公司、鷹潭蛇伊生健康管理有限公司5家公司已處于公司注銷狀態,另外,吉安市康情母嬰健康咨詢有限公司已被列為失信被執行人。
同時,青眼發現,不少企業僅備案了幾款產品,目前產品已基本處于注銷或備案異常狀態。不過,也有少量企業有推出新品,如新干美黛妍化妝品有限公司在去年12月份,備案了茶樹、甘菊、薰衣草、馬士革4種純露。
正如多位業內人士向青眼表達的觀點,“就近一兩年的情況來看,真正有實力、正規的化妝品企業受新條例的影響都不太大,那些倒閉的、跟不上監管步伐的,其實都是不夠正規的中小微企業。所以,假設企業還想活在舊法規里,只是一味‘叫苦’,不愿跟著節點一步步落地,最終只會落得淘汰的結局。”



