文|聚美麗 布瓜 嵐
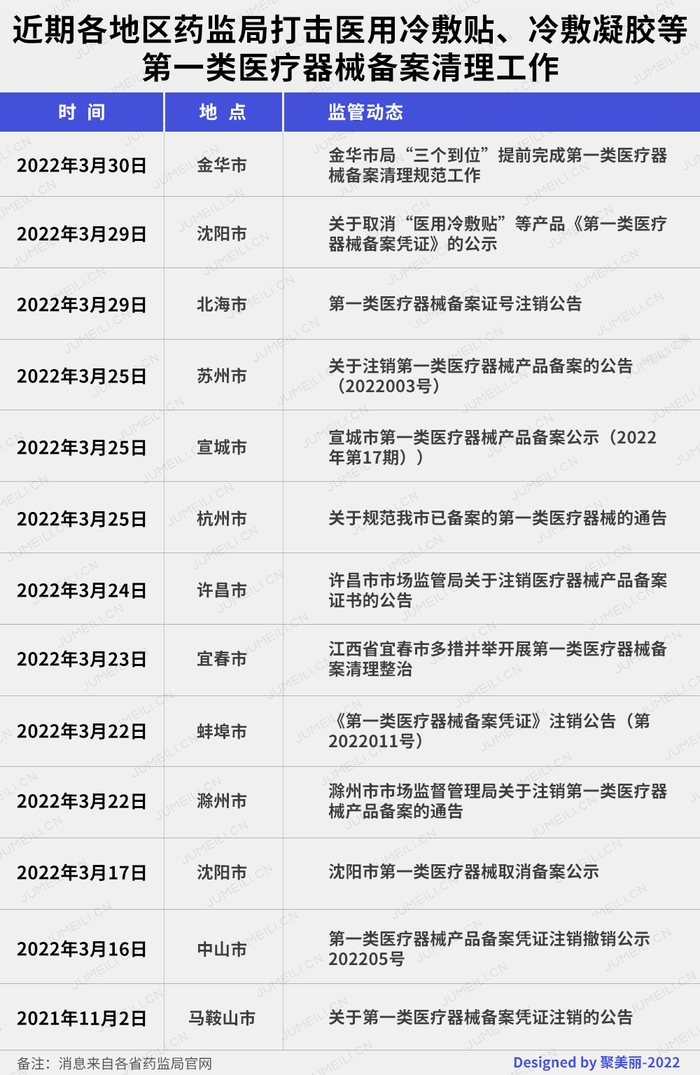
”對'醫用冷敷貼'等產品予以取消備案,公示名單見附表“、“共注銷第一類醫療器械產品備案憑證36個,完成產品備案變更23個,完成生產備案變更13家”、“經我局核實,三個第一類醫療器械產品備案號予以注銷,現予公布。”
隨著4月1日“大限日”的到來,金華市、北海市、沈陽市市場監督管理局紛紛發布以上公告,宣布提前完成第一類醫療器械備案清理規范工作。
而在本月早些時候,包括蘇州、宣城、杭州等地市場監管局均發文表示已經取消備案的產品,備案人不得繼續以第一類醫療器械產品名義組織生產;已經變更或者取消備案、但已上市的產品,備案人應當做好召回工作。
3月31日,是一類的醫用冷敷貼從市場上“被刪除”前的最后一天,意味著這類產品自此不復存在。
近些年來,醫用敷料市場存在一些亂象,特別是2018年-2019年醫用敷料剛站上風口時尤甚。市場上出現了“醫用冷敷貼”、“冷敷凝膠”等產品,被不少廠商宣稱為醫美面膜,以區別于普通護膚面膜,特別是一些宣傳中提到,“械字號面膜”就是“院線同款”。

為此,國家監管部門持續出臺相關政策,嚴厲打擊此類“醫美面膜”。
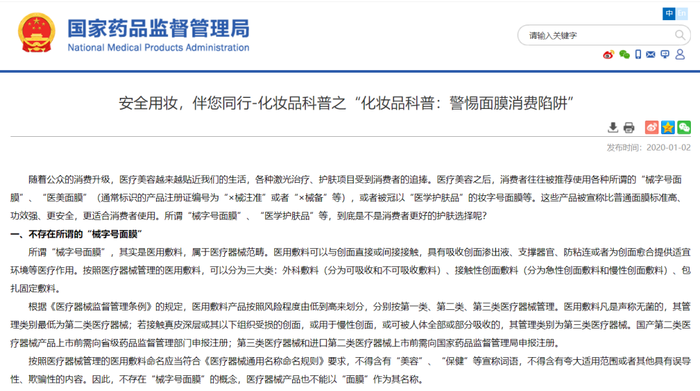
2020年1月2號:定性
2020年1月2號,國家藥監局發布《化妝品科普:警惕面膜消費陷阱 》公告,指出不存在“械字號面膜”。所謂“械字號面膜”,其實是醫用敷料,屬于醫療器械范疇。
醫用敷料凡是聲稱無菌的,其管理類別最低為第二類醫療器械;若接觸真皮深層或其以下組織受損的創面,或用于慢性創面,或可被人體全部或部分吸收的,其管理類別為第三類醫療器械。
國產第二類醫療器械產品上市前需向省級藥品監督管理部門申報注冊;第三類醫療器械和進口第二類醫療器械上市前需向國家藥品監督管理局申報注冊。
自國家藥監局發聲后,全國范圍內對“第一類醫用冷敷貼”等醫療器械展開拉網式整頓。
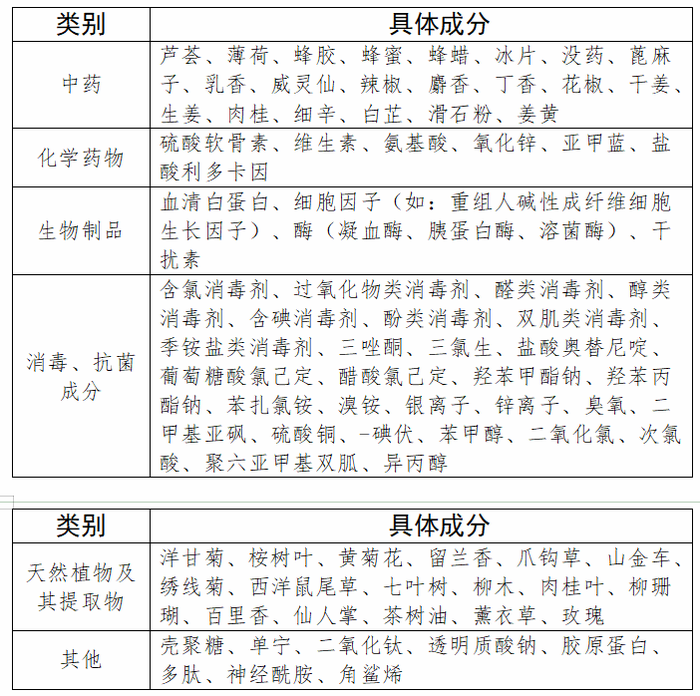
2021年8月:發布醫療器械產品目錄修訂草案
2021年8月,國家藥監局發布的《第一類醫療器械產品目錄》修訂草案(征求意見稿)對第一類醫療器械產品禁止添加成分名錄做出了規定,神經酰胺、膠原蛋白、多肽、透明質酸、玫瑰提取物、洋甘菊提取物等化妝品常見成分都擬禁止添加在第一類醫療器械中。若此次征求意見稿能夠落地,對于第一類醫療器械和化妝品將會有一定的區隔作用。
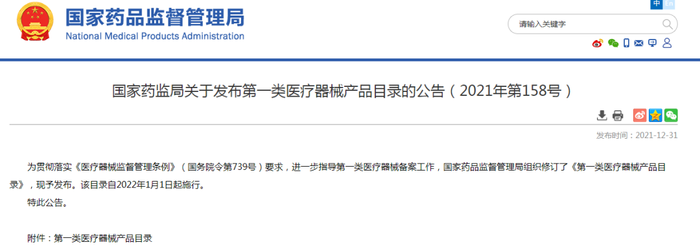
2021年12月31號:明確刪除品名
2021年12月31日,國家藥監局發布“第一類醫療器械產品目錄的公告(2021年第158號)”,明確刪除“醫用冷敷貼、醫用冷敷頭帶、醫用冷敷眼罩、冷敷凝膠”等品名,同時公布了禁用成分目錄。
這意味著,第一類醫療器械中不再含“醫用冷敷貼”。并且,相關第一類醫療器械也不得添加中藥、天然植物及其提取物等成分。
自2022年1月1日起,所有產品應當按照新修訂的《第一類醫療器械產品目錄》實施備案,其中有四類產品需要在2022年4月1日前完成備案變更。

在第二類和第三類醫療器械中,企業仍可使用醫用冷敷貼的品名,但比起第一類實行備案管理,二類和三類采取注冊制,門檻和監管更為嚴格,實行注冊制,分別由省局和國家藥監局審批,門檻層層遞進。
2022年3月2日:明確第一類責任和義務
2022年3月2日,國家藥監局發布了《關于第一類醫療器械備案有關事項的公告(征求意見稿)》,向全社會公開征求意見,反饋截止時間為2022年3月31日。
藥監局明確了第一類醫療器械備案人和備案部門的責任和義務。同時,為方便后續的備案工作,《意見稿》附上了第一類醫療器械備案資料要求及說明、備案表(格式)、備案信息表和第一類體外診斷試劑和備案操作規范。
其中,第一類醫療器械的備案資料包括:第一類醫療器械備案表、關聯文件、產品技術要求、產品檢驗報告、產品說明書及最小銷售單元標簽設計樣稿、生產制造信息以及符合性聲明。
在新一版的《關于第一類醫療器械備案有關事項的公告》正式發布時,原國家食品藥品監督管理總局發布的《關于第一類醫療器械備案有關事項的公告》(2014年第26號)將同時廢止。
而醫用冷敷貼,也同時成為歷史。
參考資料:
《被模糊的邊界:醫用敷料與面膜到底有什么區別?》
《藥監局發布意見稿,這類產品將迎來備案新依據》



