文|財健道 張羽岐 吳妮
編輯|尹莉娜
2020年7月,“70萬一針罕見病藥”話題沖上百度熱搜。這款“天價藥”,是SMA(脊髓性肌萎縮癥)領域革命性產品諾西那生鈉。輿論熱潮背后,其研發廠商渤健(Biogen),也因此在中國被廣為人知。
SMA是脊髓型肌萎縮癥的簡稱,被稱為“嬰幼兒遺傳病頭號殺手”。SMA患兒出生不久,便逐漸喪失各種運動功能,包括呼吸和吞咽等功能。如果沒有特效藥,患兒大多活不過2歲。
諾西那生鈉是全球首款針對SMA的精準靶向藥物。全國登記在冊的1600多名患兒需終生用藥,第一年140萬,以后平均每年花費105萬。罕見病的民生問題,牽動著總理的心,他力推罕見病進醫保,以降低民眾負擔。
2021年底的國家醫保談判上,諾西那生鈉被成功納入國家醫保目錄,每針3.3萬元。
時隔幾個月,渤健再次被公眾所關注,卻充斥著“裁員”“出售股權”“藥物被FDA裁決”等負面關鍵詞。“領頭羊”渤健何去何從,對中國罕見病創新藥企業具有重要啟示。

2022年3月28日,渤健(BIIB.NASDAQ)公布治療肌萎縮側索硬化(ALS)的反義核酸藥物BIIB078臨床一期試驗的一線結果,結果顯示藥物并無臨床益處,渤健和Lonis決定終止其臨床試驗,及時止損。
在此之前的2016年,渤健也曾因脊髓性肌萎縮癥(下稱“SMA”)治療藥物迎來高光時刻。但新藥研發是“九死一生”,渤健亦不能幸免,過去幾年曾多次在臨床階段折戟。
據媒體報道,渤健發言人表示:“公司正在實施成本削減的措施,通過裁員,預計每年節省5億美元”。
阿爾茨海默癥研發失敗率高達99.6%,可謂千帆折戟。21世紀以來,全球創新藥企已有超320項臨床研究宣告失敗。作為神經醫學領域的頭部生物技術公司,渤健正在經歷它的“生死場”,也許4月11日前能夠塵埃落定,Aduhelm還有希望成為下一個諾西那生鈉嗎?
01、壯志難酬
將諾貝爾化學獎得主、諾貝爾醫學獎得主以及乙肝疫苗的研發者湊在一起,他們能做什么?
——創辦渤健公司。
渤健(Biogen)誕生于1978年,專注于神經科學領域。它的創始人團隊可謂是豪華陣容,1980年創始人之一Walter Gilbert博士獲得諾貝爾化學獎;1993年另一位創始人Phillip Sharp博士諾貝爾生理學或醫學獎;Kenneth Murray博士也因研發出乙肝疫苗而被封為爵士。強大的創新基因,加上40多年的沉淀與發展,讓渤健逐漸成為神經系統疾病領域的一哥,且在多發性硬化癥(MS)領域和脊髓性肌萎縮癥(SMA)領域獨領風騷。
2013年,渤健研發的富馬酸二(Tecfidera)獲美國FDA批準,成為全球MS治療領域使用最為廣泛的口服藥物之一。2019年,Tecfidera的銷售額達到44.33億美元的巔峰值。同年,富馬酸二甲酯的升級版本富馬酸地洛西美(Vumerity)成功接力,獲FDA批準上市,憑借更好的胃腸道耐受性和安全性在市場上占有一席之地。
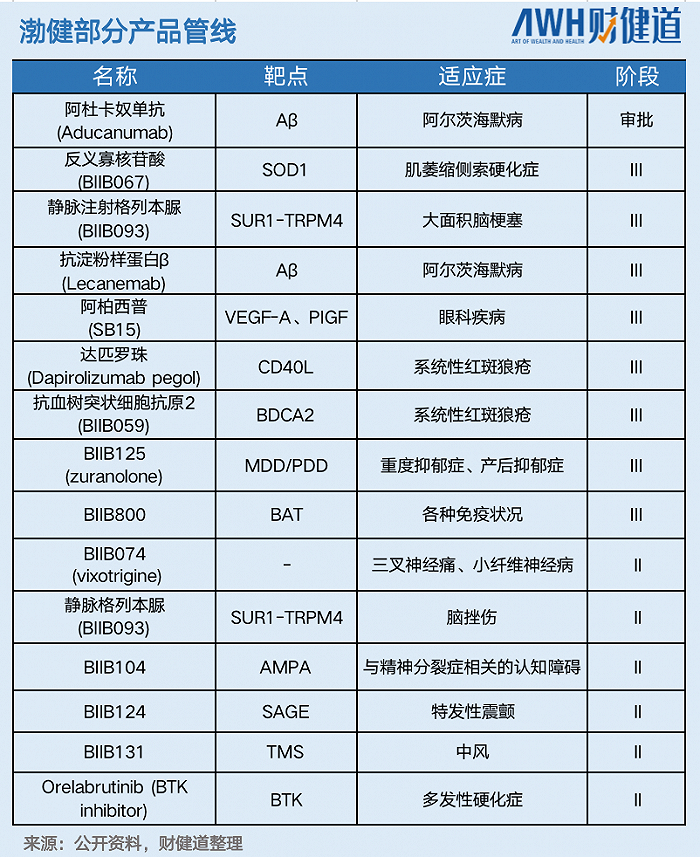
2016年渤健研發出全球第一款用于SMA的治療藥物——諾西那生鈉(Spinraza),為罕見病領域帶來了重大突破。憑借先發優勢,截至2021年底,諾西那生鈉已累計為渤健帶來了近90億美元的銷售額。
諾西那生鈉和富馬酸二甲酯(富馬酸地洛西美)成為兩駕馬車,拉著渤健越跑越快。然而好景不長。2020年,巨大的隱患浮出水面。 首先是富馬酸二甲酯的專利問題。渤健曾對富馬酸二甲酯進行了一系列的專利布局,將市場壟斷時間爭取到2028年。
但這只是渤健的一廂情愿。2019年2月,邁蘭向渤健發起了對富馬酸二甲的專利挑戰,并獲得勝訴,提前結束了富馬酸二甲市場獨占期。隨后,仿制藥蜂擁而至。國內經CFDA批臨床的就有江蘇豪森、濟南百諾、杭州和澤等8家企業。在仿制藥的沖擊下,富馬酸二甲酯2020年業績為39.05億美元,同比下跌12%;2021年這一數字降為23.62億美元,再跌39.5%。
SMA領域也不甚樂觀,雖然諾西那生鈉的專利2023年才到期,但競品早已逼近。諾華的Zolgensma和羅氏/基因泰克的Evrysdi分別于2019年和2020年上市,蠶食著諾西那生鈉的市場。諾西那生鈉的銷售額從2020年的20億美元降至2021年的19億美元,而Zolgensma的2021年銷售收入達到13.51億美元,同比增長47%。其次是研發上“青黃不接”。為了在SMA和MS領域保持優勢,渤健從未停止創新。可惜,卻未能如愿獲得突破性進展。
2021年8月,多發性硬化癥藥物opicinumab研發止步于II期臨床試驗,因為該藥在II期AFFINITY研究中未到達主要和次要終點。2022年1月,渤健從Ionis Pharmaceuticals引進一種治療SMA的藥物——BIIB115/ION306的全球獨家許可,然而距離上市任重道遠。
直到現在,無論是在SMA和MS領域,還是新業務領域,渤健都沒有等來下一個增長點。
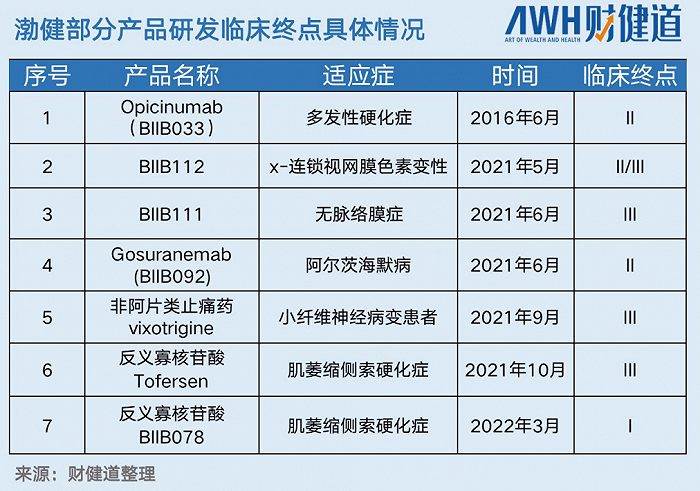
被寄予厚望的阿爾茨海默病藥物Aduhelm安全性爭議不斷,據渤健2月3日公布的2021年財報,Aduhelm自6月上市以來銷售額僅300萬美元,遠低于預期。
基因療法BIIB111和BIIB112、非阿片類鎮痛藥物vixotrigine(BIIB074)、反義寡核苷酸藥物tofersen、肌萎縮側索硬化癥(ALS)候選藥物BIIB078先后宣告臨床失敗。
02、危機四伏
研發的連番失利,讓以創新藥為立身之本的渤健危機四伏。
最直觀的感受是業績下降明顯。2020年渤健的營收在14家跨國藥企中墊底,2021年渤健再刷新低,營收繼續同比下滑18.3%。股價也創下歷史新低,距離其2021年8月高點,下跌超過36%。

開源不成,渤健開始考慮節流。
2021年12月,已有100多名員工被解雇,包括三分之二的阿爾茨海默癥藥物Aduhelm商業化團隊。另據媒體3月初報道,渤健可能繼續裁掉多達1000名的員工,以期節省高達7.5億美元的資金。
令人唏噓的是,與本次裁員計劃同步離開渤健的高管還有——渤健首席研發官AlfredSandrock,渤健負責全球制造的元老AlphonseGaldes。
今年2月,渤健以高達23億美元的價格,將其在三星Bioepis公司的股權(49.9%的股份)出售給三星生物。收購完成后,兩家公司將繼續執行之前簽署的獨家協議,包括將目前的投資組合(依那西普、阿達木單抗、英夫利西單抗)商業化。此外,渤健還擁有雷珠單抗和在研阿柏西普生物類似藥的獨家商業化權利。裁員與出售股權,或是沒有辦法的無奈之舉,也開啟了一個向下的螺旋周期。 一路走來,渤健的紅與黑同樣鮮明,皆由產品決定。神經性疾病藥物歷來被稱為醫藥研發領域的“喪鐘”,在阿爾茨海默癥領域更是浪花滾滾,但收效甚微,超過99%的藥物最后流落塵土,能夠留下的是“精品中的精品”。可想而知,渤健(Biogen)走的這條路有多么的艱難。
去年10月,渤健坦然宣布肌萎縮側索硬化癥(ASL)的在研藥物Tofersen的III期試驗Valor研究進入“終點”,通俗解釋就是這款藥物最終可能研發失敗。對于原研藥物來說,這并不是什么新鮮事,失敗是經驗的積累,成功才是偶然的勝利。渤健的Aduhelm(aducanumab,阿杜卡奴單抗)大抵如此。
據美國藥品研究與制造商協會(PhRMA)的報告數據顯示,從1998-2017年,全球有146款阿爾茨海默病藥物進入臨床試驗“終點”,僅4款藥物成功走向市場。也就是說,每37種藥物中只有1種藥物能獲得“成功”。
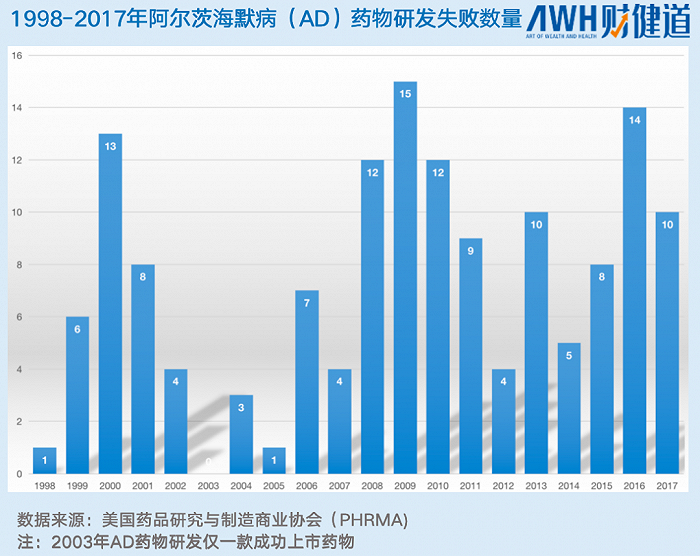
然而研發的“成功”只是第一步,能否推向市場還需“過五關斬六將”。
2021年6月7日,FDA宣布,渤健阿爾茨海默病新藥Aduhelm(aducanumab,阿杜卡奴單抗)獲批使用。消息傳出后,渤健股價大漲,畢竟AD的藥物研發難度甚高,而Aduhelm是FDA近30年來審批的第七款AD藥物,也是該領域藥物時隔7年的再次獲批。
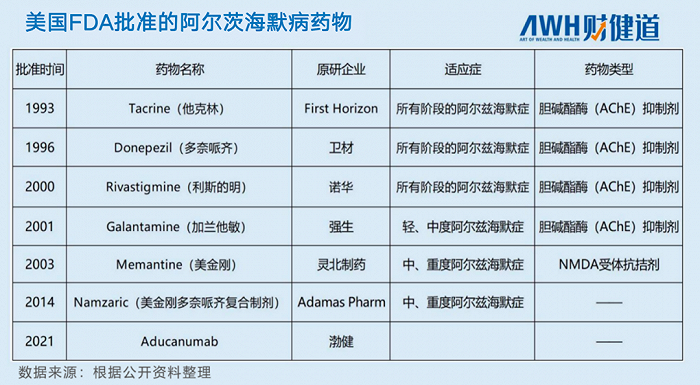
盡管渤健的Aduhelm獲得FDA的“認可”,但爭議也接連不斷,領域內專家會議席上的爭吵,領域外各國市場的不認同……銷售斷崖,甚至于受到美國醫療保險和醫療補助服務中心(CMS)的限制。
FDA中各個專家小組在長達七小時的咨詢會議中爭論不休,“腦部的淀粉樣蛋白與阿爾茨海默病的致病機制之間的關聯具有不確定性”。神經學家和生物統計學家認為,渤健的實驗數據不具備有效性和完整性。
一面,專家小組認為FDA有包庇渤健的嫌疑,甚至有3位FDA咨詢委員會專家接連辭職,直指FDA。他們認為FDA雖然指出了生物統計學的數據漏洞,但在神經學審查中仍然批準了渤健的研發藥物—Aduhelm。另一面,阿爾茨海默病協會、美國神經病學學會、國際阿爾茨海默病協會等紛紛表示支持渤健的AD新藥,最終FDA也批準了它。
03、行而不輟
正在經歷裁員風波、營收斷崖的渤健,看起來十分狼狽,但實際上,這卻是新藥研發的必經之路。相比于渤健,那些臨床試驗造假、“偽創新”的biotech企業才是產業沉浮中真正的“泡沫”。
行業人士指出,“藥物臨床試驗中數據不規范、不完整的現象依舊嚴重”。早在2015年原國家食藥監總局的“7·22核查風暴”中就探尋一些端倪。在1622個藥物臨床試驗項目中,有超過八成的新藥申請被藥企撤回或是被原國家食藥監總局“不予通過”。就連跨國藥企默沙東(MRK.NYSE)、百時美施貴寶(BMY.NYSE)也曾被FDA撤銷適應癥。
2021年7月2日,一紙文件映入眼前。國家藥監局藥品審評審批中心(CDE)下發《化學藥品創新藥上市申請前會議藥學共性問題相關技術要求(征求意見稿)》和《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則(征求意見稿)》,特別針對腫瘤藥物提出與最新治療方案的頭對頭臨床試驗,并闡明產品商業化差異性。業內稱之為“打擊偽創新”,一時間,創新藥研發的道路看起來正在縮窄。盡管新藥研發九死一生,有人夭折,有人幸運,但是不得不說,生物研發無論是現在或是將來都是一個燒錢的“事業”,就看誰能堅挺到最后。
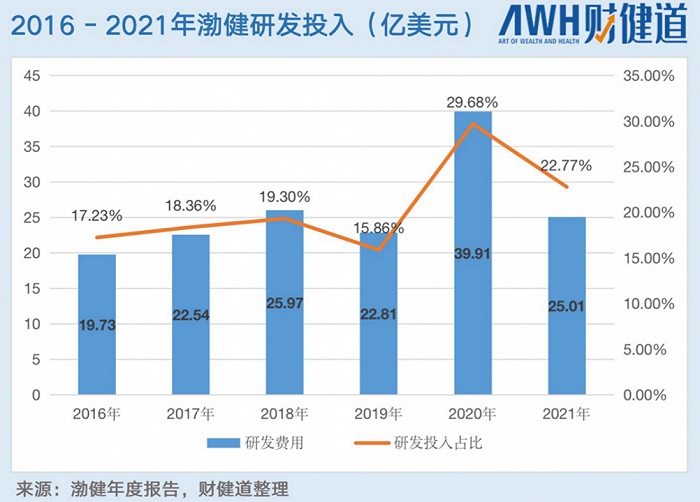
從2016年-2021年,渤健的研發投入穩步上升,2020年達到近幾年峰值,研發費用達39.91億美元,研發投入比占29.58%,但2021年受到疫情、AD新藥研發等多重因素影響,研發投入有所下降,投入金額25.01億美元,研發投入同比下降6.91%.
在這場曠日持久的“爭議”中,盡管Aduhelm備受阻撓,渤健始終沒有放棄。2021年12月中旬,渤健宣布與其開發合作伙伴衛材一起,開展臨床IV試驗,預計在研究開始后的四年內完成。做為IV期試驗的一部分,渤健和衛材計劃招募18%來自非裔美國人和拉丁裔人群的美國患者,渤健表示此舉也是不斷致力于增加Aduhelm臨床試驗多樣性的一部分。
同時,渤健仍舊在神經科學的各個領域內探索。渤健用于治療肌萎縮側索硬化(ALS)的在研反義寡核苷酸藥物BIIB078已經終止了臨床試驗。3月30日晚,FDA正在召開PCNSDAC會議,討論另一款ALS的新藥-Amylys的AMX0035,FDA仍然質疑它的有效性,至于結果如何,還在等待中。
對渤健來說,美國醫療保險和醫療補助服務中心(CMS)的“最后裁決”還未到來(時間為2022年4月11日前),Aduhelm能走到哪一步也不可知,渤健還能出來下一個SMA嗎?或許它還在路上。
原國家食藥監總局局長畢井泉說,創新藥的高風險,應該對應高回報。(點擊超鏈接閱讀原文)
面對九死一生的高風險,放棄的人居多,但是臨床、市場,需要更多的人加入,就需要高回報的機會。如果高風險而沒有相應的回報,那么對于這種高失敗率的生物醫藥產業,誰還愿意盡一份力呢?
(作者系《財經》研究員)
制圖|李紫雅
參考資料 【1】大規模裁員?首席研發官被踢!渤健阿爾茨海默藥Aduhelm業績慘敗后何去何從.新浪醫藥. haon. 2021.12.09
【2】美國CMS限制渤健Aduhelm醫療保險覆蓋范圍.新浪醫藥新聞.李湯姆.2022.01.13【3】21大深度|狙擊醫藥“偽創新”.21深度.2021.07.20
【4】八成新藥臨床數據涉假 背后監管環節層層失守.經濟參考報.凌軍輝、肖思思、張麗娜.2016.09.09
【5】在中國,122萬人正在“中年癡呆”.財健道.張羽岐、漢雨棣.2021.09.23
【6】醫保拒付,負面頻現:藥物經FDA批準上市后,還有多少道難關要過. 深藍觀. 方澍晨。2022.02.28
【7】BIOGEN REPORTS FOURTH QUARTER AND FULL YEAR 2021 RESULTS
【8】Biogen - 2020 Annual Report .2021. 04.09.
【9】數據失真、PD-1扎堆,FDA反內卷,中國創新藥企怎么辦.財健道.嚴瑞.2022.01.05 【10】李勇(2022-01-17).藥企巨頭全力應對“專利懸崖”.醫藥經濟報,F04.
【11】解一章.(2021).阿茲海默病新藥研發漫途. 看世界(03),78-81.
【12】韓璐.(2019).阿爾茨海默病的戰役. 21世紀商業評論(12),28-37.
【13】美版“971”|FDA力排眾議,批準Biogen阿爾茲海默單抗Aducanumab.藥融圈.2021.06.08



