文|動脈網
醫療人工智能注冊審批推進緩慢,相關制度的缺失是其關鍵原因。作為非傳統類的軟件類醫療器械,人工智能所使用的算法、調用的數據、作用的目標都在傳統指導原則之外,審評審批人員不得不摸著石頭過河,謹慎推進醫療人工智能的注冊審批。
3月7日,國家藥監局器審中心發布了一份長達41頁的《人工智能醫療器械注冊審查指導原則》(后簡稱《指導原則》),標志著上述現象成為過去式。本次指導原則事無巨細的描述了人工智能醫療器械的概念、注冊基本原則、人工智能醫療器械生存周期過程、技術考量等部分,給予了注冊企業明確的規定與標準。
為了理解《指導原則》背后的影響,洞悉醫療AI未來的發展方向,動脈網采訪了相關專家,對政策內容進行全面梳理,嘗試幫助醫療AI的從業人員理清藥監局審批的思路與要點。本篇內容將從《指導原則》的增量信息、醫療人工智能企業的調整方向、醫療人工智能行業的整體發展三個方面切入,逐一解讀政策全文。
5大關鍵解析增量信息
從屹立風口到穩步前行這七年,器審中心在醫療AI相關文件的發布上一向惜字如金。上一份全面的指導原則《深度學習輔助決策醫療器械軟件審評要點》發布于兩年前,新標準下,人工智能醫療器械有了通用指導標準,如今的審批審評要求也與過去有了極大的區別。

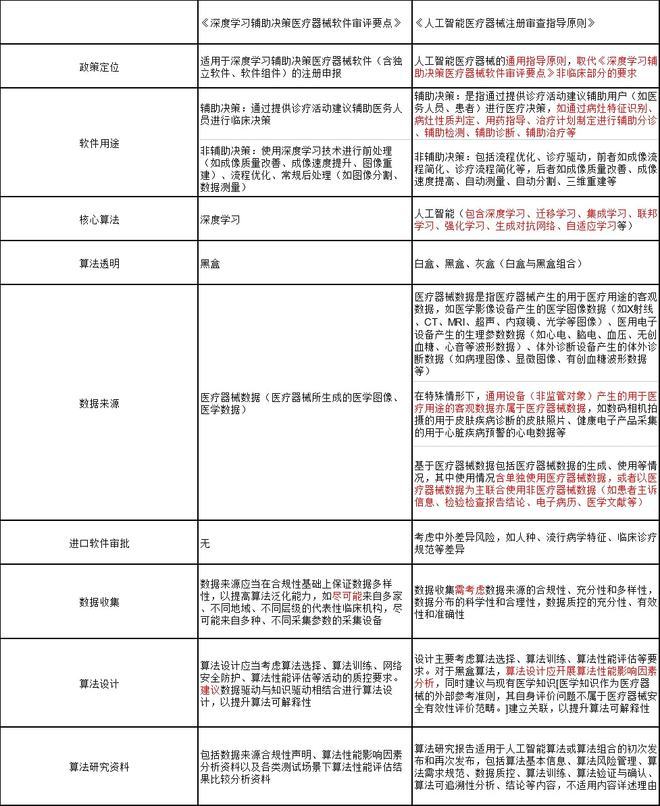
《人工智能醫療器械注冊審查指導原則》與《深度學習輔助決策醫療器械軟件審評要點》關鍵增量信息對比
關鍵信息對比上,前后兩版政策在定位、軟件用途、核心算法、算法透明等方面有了實質性的變化,而在數據收集、數據來源、算法設計上則進行了措辭的變更。
? 關鍵點一:醫療人工智能再定義
因此,上一輪人工智能政策被命名為《深度學習輔助決策醫療器械軟件審評要點》,實則是對主流算法的規范與標準。從審批結果來看,器審中心通過的前12個醫療人工智能器械都在審批文件中標注了“深度學習”四個字。
然而,隨著人工智能算法的不斷發展,深睿醫療、聯影智能、騰訊醫療等企業不斷嘗試小樣本學習、無監督學習等新式人工智能算法,這些新的研究結果同樣屬于人工智能,但卻未被審評審批包含其中。尤其是有監督學習下的人工智能,文件之中濃墨重彩地強調了它的積極意義。

各類人工智能算法的內容與監管
醫準智能聯合創始人兼CTO丁佳表示:“人工智能醫療器械的審批本是在不斷摸索著前行,若企業提出一些深度學習之外的創新算法,常常需要跟藥監局來回溝通很多遍,才能確定注冊時使用的產品功能與適用范圍等信息。”
由此來看,《指導原則》發布的核心意義之一,是對人工智能的再定義。新政策下,各類創新人工智能算法有望加速通過該政策通過審評審批。
? 關鍵點二:算法的透明性
在《深度學習輔助決策醫療器械軟件審評要點》中,“審評關注重點”一節的第一句就聲明了“深度學習實為基于海量數據和高算力的黑盒算法”,因而后續的關注要點聚集于數據質量控制、算法泛化能力、臨床使用風險等方向。
而在《指導原則》中,文件對人工智能所采用的算法作了“白盒”和“黑盒”的區分,要求白盒算法無論是有監督學習還是無監督學習,模型/數據質控要求均參照有監督深度學習執行,均需明確特征信息,如特征分類(如人口統計學、生物學、形態學)、特征屬性(如形態、紋理、性質、尺寸、邊界)、特征展現方式(如形狀、尺寸、邊界、顏色、數量)等信息。
在這一部分,動脈網曾提出“黑盒算法是否會在未來逐漸退出醫療人工智能輔助決策軟件的使用要求”,對此醫準智能聯合創始人兼CTO丁佳表示:“盡管政策希望企業采用手動特征提取等方式加強算法的可解釋性,但從目前行業來看,黑盒算法的準確率遠超白盒算法,雖然不能解釋,但可借助穩定性、魯棒性等性能指標驗證黑盒算法的可行性。”
? 關鍵點三:軟件用途明確區分
通常情況下,我們習慣于視影像類AI為輔助診斷軟件。在過去政策關于軟件用途的定義之中,僅區分輔助決策與非輔助決策兩類,具體的用詞方式僅出現于三類證的發布之中。如今,《指導原則》對“輔助決策”四個字進行了精確的區分。
新標準下,人工智能醫療器械被劃分為輔助分診、輔助監測、輔助診斷、輔助治療。回顧審評審批,鷹瞳科技、硅基智能、致遠慧圖的糖網病變、安德醫智的顱內腫瘤磁共振等歸類于輔助診斷;深睿醫療、推想科技的肺結節CT,匯醫慧影的骨折x射線等歸類于輔助檢測;推想科技、聯影智能、騰訊醫療的肺炎CT被分類為輔助分診,由此可見軟件的劃分與AI的成熟度無關,與AI所解決的問題有關。
? 關鍵點四:數據來源
《深度學習輔助決策醫療器械軟件審評要點》對于人工智能醫療器械的數據來源沒有做詳細的解析,只是提到是“醫療器械所生成的醫學圖像、醫學數據”。
在《指導原則》中,醫療器械數據被明確定義為是指醫療器械產生的用于醫療用途的客觀數據,如醫學影像設備產生的醫學圖像數據(如X射線、CT、MRI、超聲、內窺鏡、光學等圖像)、醫用電子設備產生的生理參數數據(如心電、腦電、血壓、無創血糖、心音等波形數據)、體外診斷設備產生的體外診斷數據(如病理圖像、顯微圖像、有創血糖波形數據等)。
值得注意的是,在特殊情形下,通用設備(非監管對象)產生的用于醫療用途的客觀數據亦屬于醫療器械數據,如數碼相機拍攝的用于皮膚疾病診斷的皮膚照片、健康電子產品采集的用于心臟疾病預警的心電數據等,這意味著,基于體素科技、丁香園等皮膚輔助決策小程序,患者用手機拍攝的皮膚照片同樣可以被視為醫療數據,該項要求給予了皮膚類AI企業更多進步的空間。
此外,文中還提到“基于醫療器械數據包括醫療器械數據的生成、使用等情況,其中使用情況含單獨使用醫療器械數據,或者以醫療器械數據為主聯合使用非醫療器械數據(如患者主訴信息、檢驗檢查報告結論、電子病歷、醫學文獻等)”。換句話說,在未來的人工智能醫療器械審批中,文本類數據也有望成為重要的補充,甚至成為單獨的人工智能工具。
2021年7月,森億智能的VTE系統便獲得了國家藥品監督管理局給予的二類證,可以預見,未來將會有一大批企業會陸續跟進申請VTE系統的醫療器械注冊證審批。
? 關鍵點五:數據收集與算法設計中的措辭變化
數據收集與算法設計兩個關鍵環節決定了醫療人工智能的實際性能,無論是《深度學習輔助決策醫療器械軟件審評要點》,還是《指導原則》都對這兩部分進行了精細的描述。畢竟,在過去的審評審批之中,很多企業的算法準確性、敏感性、魯棒性達不到監管機構的要求,其中的關鍵原因就是在這兩個環節出了問題。
在《深度學習輔助決策醫療器械軟件審評要點》中,器審中心沒有明確要求數據來自不同的數據來源,只是讓企業盡可能地保證數據的多樣化,而在《指導原則》中,器審中心要求企業“需考慮數據來源的合規性、充分性和多樣性,數據分布的科學性和合理性,數據質控的充分性、有效性和準確性”,希望從審批環節就推動企業提高人工智能醫療器械的魯棒性。
算法設計同樣存在類似轉變。《深度學習輔助決策醫療器械軟件審評要點》僅建議企業進行數據驅動與知識驅動相結合進行算法設計,以提升算法可解釋性,《指導原則》則要求黑盒算法開展算法性能影響因素分析,提升算法可解釋性。
對于企業而言, 官方指導像是一座燈塔,燈光引領之下,企業不再于黑暗中摸索,一切開始變得有條理。
“從短期來看,流程的規范化提出了一些新的要求,企業可能會在申請前做更多的多中心實驗,進行多維度數據集的測試,這些流程可能會提升醫療人工智能企業在研發、注冊方面的成本。”丁佳表示,“但將眼光放遠,規范的體系必然在長期之中保有優勢,保證醫療人工智能的質量,帶動人工智能醫療器械CRO、數據集驗證等產業鏈的發展,并使得研發企業的注冊成本更為穩定。”
可以預見,在未來的一年中,我們有望看到更多元、更豐富的人工智能醫療器械在醫院之中落地生根,而當產業發展走向穩定之后,質子重離子、腦科學等尚在發展之中的領域有望出現一波新的AI機遇。
從人工智能到數字醫療
指導原則之外,藥監局還在3月7日、3月9日陸續發布了《國家藥監局器審中心關于發布醫療器械網絡安全注冊審查指導原則(2022年修訂版)的通告(2022年第7號)》、《家藥監局器審中心關于發布醫療器械軟件注冊審查指導原則(2022年修訂版)的通告(2022年第9號)》兩大文件,其中的目的,是要建立完善全面的的數字醫療審評審批體系。
如今數字療法、臨床輔助決策等新興概念飛速發展,不只是人工智能,數字醫療浪潮中涌現的各種事物都需要配套的審批進行規范,為產業的良性發展保駕護航。
對于人工智能而言,新政策的出現或許不會將其再度推上風尖浪口,但當眾人逐漸形成對于AI共識,將數字醫療的介入視作一種常態,這個時候,徘徊數年的醫療人工智能企業或將加速駛入盈利時代。



