界面新聞記者 | 郭凈凈
近期,南京維立志博生物科技股份有限公司(簡稱“維立志博”)遞交港交所主板IPO上市申請材料獲受理并披露。12月8日,公司宣布,進一步委任招銀國際融資有限公司為其整體協調人。
維立志博稱,公司此次港股IPO募資將用于公司臨床階段候選藥物正在進行及計劃進行的臨床開發及監管事務,比如核心產品LBL-024的持續臨床開發及監管事務提供資金;為公司管線中其他臨床階段候選藥物(特別是主要產品LBL-034)的持續臨床開發及監管事務提供資金;推進及擴展現有管線及優化技術平臺;將于候選藥物獲批準銷售后用于其生產、銷售及市場推廣;用于營運資金及一般企業用途。
旗下12項創新候選藥物均處于臨床階段
維立志博于2012年成立,是一家臨床階段生物科技公司,致力于在腫瘤、自身免疫性疾病及其他重大疾病方面的創新療法發現、開發及商業化,公司已建立從早期篩選及發現、臨床前研究、臨床開發、CMC到中試生產的整個藥物開發過程中的所有基本功能。
招股書顯示,維立志博創新管線包括12項主要資產(創新候選藥物),其中6款已進入臨床階段,包括1款核心產品及3款主要產品;分別為針對腫瘤的3款單克隆抗體、4款雙特異性抗體、2款抗體偶聯藥物(ADC)及1款雙特異性融合蛋白,以及針對自身免疫性疾病的1款雙特異性融合蛋白及1款三特異性抗體。

在這12款創新候選藥物中,6款已成功進入臨床階段,該公司正單獨進行合共10項臨床項目評估。迄今為止,公司有2款候選藥物于3種適應癥的II期臨床試驗中獲得概念證明,且該等候選藥物中有1款進展至關鍵性臨床試驗階段。


其中,維立志博的核心產品LBL-024是一款處于關鍵性臨床階段的新型PD-L1與4-1BB雙特異性抗體。公司目前正在評估LBL-024(作為單藥療法及聯合療法一部分)對于治療晚期肺外神經內分泌癌、小細胞肺癌、膽道癌、非小細胞肺癌及其他實體瘤的療效。
該公司透露,LBL-024已于2024年7月進入針對肺外神經內分泌癌的單臂關鍵性臨床試驗,是全球達到關鍵性臨床試驗階段的首款4-1BB靶向候選藥物。LBL-024亦有可能成為治療肺外神經內分泌癌的首款獲批藥物。
此外,維立志博于2024年10月自國家藥品監督管理局(NMPA)獲得LBL-024治療后線肺外神經內分泌癌的突破性療法認定(BTD),并于2024年11月自美國食品藥品監督管理局(FDA)獲得LBL-024治療神經內分泌癌的孤兒藥認定(ODD)。
該公司計劃進一步研究其對其他藥物匱乏的癌癥適應癥的治療潛力,例如食管鱗狀細胞癌、胃癌及肝細胞癌。就有關關鍵性臨床試驗的臨床進展而定,公司有望至2026年第三季度向NMPA提交生物制品許可申請(BLA),預計至2027年第二季度獲得有條件批準。
維立志博主要產品LBL-033為同時靶向MUC16及CD3的雙特異性T細胞銜接抗體。該產品正被開發用于治療MUC16高表達的實體瘤,特別是卵巢癌、宮頸癌及子宮內膜癌等婦科癌癥。根據弗若斯特沙利文資料,LBL-033已躋身全球僅有的兩款已進入臨床階段的MUC16/CD3雙特異性抗體之列。公司分別于2023年2月及2023年6月獲得NMPA及FDA的IND批準,于2023年4月在中國開展LBL-033單藥療法治療晚期實體瘤的I/II期研究。
另據介紹,維立志博的另一主要產品LBL-007為靶向LAG3的全人源IgG4單克隆抗體。根據弗若斯特沙利文資料,該產品為全球臨床進度前三的靶向LAG3的臨床階段單克隆抗體之一(唯一上市的LAG3靶向藥物除外),亦為同類抗體中首款被證實對鼻咽癌有效的抗體。
積極商業化變現,簽約百濟神州等3家公司
維立志博指出,隨著公司后期臨床資產接近商業化上市,其可能會考慮建立具商業規模的生產設施,并透過合作及內部銷售團隊加強商業化能力。特別是,公司正在積極尋求與頭部行業參與者及創業投資建立戰略合作伙伴關系,以探索中國以外的臨床開發及商業化機會。目前,該公司已經與百濟神州、杭州百凱生物醫藥有限公司、Oblenio Bio,Inc.等訂立合作協議。
于2021年12月,維立志博與百濟神州訂立授權及合作協議。該公司已授予百濟神州在大中華區以外開發、生產及商業化LBL007的獨家許可,代價為總計高達7.72億美元的首付款及里程碑付款,另加雙位數百分比的分級特許權使用費。通過與百濟神州合作,LBL-007目前正于中國及全球就多種癌癥適應癥進行II期臨床試驗,包括非小細胞肺癌、結直腸癌、頭頸部鱗狀細胞癌、食管鱗狀細胞癌及鼻咽癌。
另據維立志博介紹,于2023年4月,該公司與癌癥創新ADC藥物公司杭州百凱生物醫藥有限公司(連同其若干海外聯屬公司,統稱“百凱醫藥”)訂立ADC合作開發協議,以利用百凱醫藥專有的ADC有效負載連接器平臺及相關專有技術,共同開發LBL-013及其他兩項臨床前ADC資產。
于2024年11月,維立志博與生物技術風險投資公司Oblenio Bio,Inc.訂立合作、獨家選擇權及許可協議。公司亦已與Aditum Bio就新成立的一家美國公司NewCo,致力于公司特定三特異性Tcellengager的全球開發及商業化達成合作安排,交易總價值高達6.14億美元,另加潛在中個位數特許權使用費及于NewCo的股權。根據協議,維立志博授予NewCo其臨床前資產LBL-051(一款CD19/BCMA/CD3 Tcellengager)獨家全球許可,NewCo可選擇于適用選擇期后行使其選擇權保留有關許可。
兩年半累虧8.23億元,成立以來募資10.84億元
維立志博目前并無產品獲準進行商業銷售,亦未自產品銷售產生任何收入。于往績記錄期間,該公司尚未錄得盈利,并存在營運虧損。財務數據顯示,2022年、2023年及2024年前6月,維立志博期內虧損分別是2.81億元、3.62億元及1.8億元,兩年半累計虧損8.23億元。
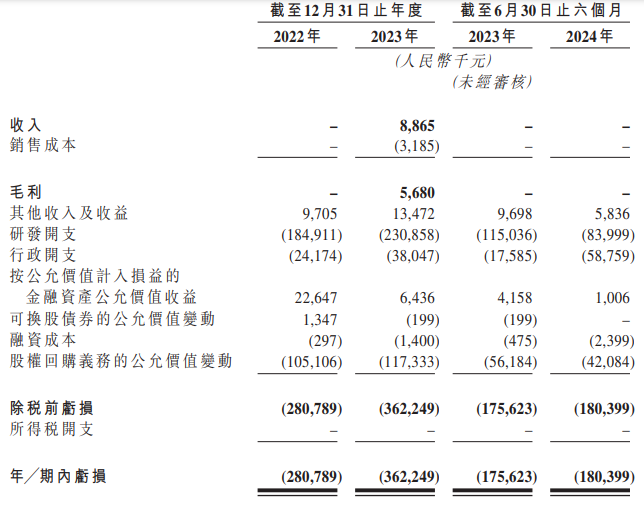
于往績記錄期間,該公司僅有百濟神州一名客戶;于2023年,根據百濟神州協議,公司就進行有關橋接研究自百濟神州收到款項共890萬元。于2022年或截至2024年6月30日止六個月,公司并無產生任何收入。
維立志博表示,其于很大程度上依賴臨床階段及臨床前階段候選藥物的成功。倘公司無法成功完成臨床開發、取得監管批準及實現候選藥物商業化,或倘于進行任何上述事項時遭遇重大延誤或成本超支,公司的業務、財務狀況、經營業績及前景將會嚴重受損。
該公司預期截至2024年12月31日止年度將繼續錄得虧損凈額。維立志博表示,預計于可預見未來將繼續產生虧損凈額,且可能無法產生充足收入以實現或維持盈利能力;未來凈虧損的金額將部分取決于研發項目所產生的成本及與營運有關的開支導致的未來支出、任何獲批產品的商業化成本、產生收入的能力以及公司與或透過與第三方的安排作出或收取的里程碑及其他付款的時間及金額。
2022年、2023年及2024年前6月,維立志博的研發開支分別是1.85億元、2.31億元、8399.9萬元,其中核心產品應占的研發開支分別為1390萬元、6870萬元、3360萬元及2700萬元,分別占同期總經營開支的6.7%、25.6%、25.4%及18.9%。
另據招股書,2022年、2023年及2024年前6月,維立志博的流動負債總額分別是12.26億元、13.95億元及2.18億元,期末現金及現金等價物分別是2.53億元、2.48億元及2.74億元,經營活動所用現金凈額分別為4369.2萬元、1.93億元及1.07億元。
自成立以來,該公司連續8輪融資“補血”,合計獲得募資10.84億元,投資所得款項的80.8%已獲動用,引入恩然創投、漢康資本、正心谷資本、懷格資本、新希望醫療、深創投、昆藥集團等投資者。公司于2024年11月最新融資后的投后估值約為31.3億元。
截至最后可行日期,維立志博共同創始人康小強、賴壽鵬及股份激勵平臺禮至合伙、引領生物有限公司及Leads Tech Limited根據他們訂立的一致行動人士協議,有權行使公司合共約20.08%的投票權。



