記者|張喬遇
近日,澤輝生物科技有限公司(簡稱:澤輝生物)赴港遞交招股書,中金公司為保薦機構。
澤輝生物是一家2017年12月在蘇州設立的生物制藥公司,專注于開發多能干細胞(PSC)來源的創新細胞治療產品。其開發的全面及差異化產品管線涵蓋了七種適應癥,其中核心產品ZH901已進入II期臨床階段。然而,截至目前,澤輝生物尚無獲批上市進行商業化銷售的產品,因此尚未產生自產品銷售收入。
此外,澤輝生物在IPO前與部分投資者簽訂了股東協議,其中授予了前投資者一些特別權利,包括在特定情況下(如公司未能在規定時間內完成IPO)要求贖回的贖回權。
IPO前,澤輝生物實際控制人金韻持有公司44.98%的股份,通過兩家控股公司Xiangjing PhaseII和Zephyrm Tongchuang PhaseII分別持股38.33%和6.65%。據悉,金韻為公司首席執行官Yu Alex ZHANG博士的母親。
尚未實現商業化銷售
根據弗若斯特沙利文的資料,澤輝生物是中國首批獲得PSC來源細胞療法新藥臨床試驗申請(IND)批準的公司。
公司開發了由四類PSC來源細胞治療產品組成的全面及差異化產品管線,涵蓋七種適應癥,包括間質性肺疾病急性加重(“AE-ILD”)、急性移植物抗宿主病(“aGVHD”)、半月板損傷、急性呼吸窘迫綜合征(“ARDS”)、帕金森病、干性年齡相關性黃斑變性(“AMD”)及角膜內皮失代償。
目前澤輝生物的產品組合包括核心產品ZH901以及主要產品ZH903、ZH902、ZH906。截至2024年9月20日,澤輝生物的核心產品ZH901已進入II期臨床階段,該產品是一種M細胞治療產品,目前正在研究用于治療AE-ILD、aGVHD、半月板損傷和ARDS。
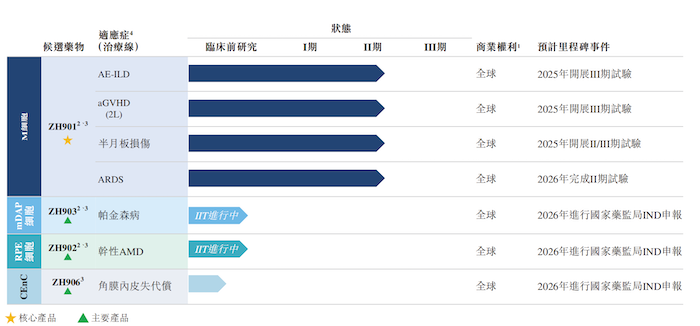
除此之外,澤輝生物的主要在研項目ZH903和ZH902目前正在進行研究者發起的試驗(“IIT”),分別用于治療帕金森病和乾性AMD。另一產品ZH906用治療角膜內皮失代償,正處于臨床前階段。
可以看到,目前澤輝生物尚無獲批上市進行商業化銷售的產品,因此沒有自產品銷售產生的任何收入。
目前來看,澤輝生物進展最快的管線也僅處于II期臨床試驗階段,相關項目臨床前及臨床試驗開支、研發材料開支、員工福利開支、適應癥研究和相關費用等研發支出金額龐大,報告期(2022年、2023年及2024年上半年)分別為6631.1萬元、1.03億元和5851.5萬元,導致報告期持續虧損。
招股書顯示,澤輝生物報告期的凈利潤分別為-1.73億元、-1.96億元、-2.37億元,累計虧超6億元,且虧損金額持續擴大。
報告期各期,澤輝生物的凈流動負債為4.55億元、6.40億元、8.00億元;負債凈額分別為3.69億元、5.65億元和6.56億元。公司預計將在2024年末繼續產生經營虧損。
值得一提的是,PSC來源細胞療法產品有兩個潛在安全問題。一個潛在問題系與殘留的PSC有關,該干細胞在移植到患者體內后可能會生長成腫瘤。另一個潛在安全問題系與移植細胞發生免疫排斥的可能性有關。
高價引進專利技術
澤輝生物開發了一個多功能干細胞來源的細胞治療研發平臺(PROF),該平臺包含多能干細胞種子細胞平臺(“PROF-seed”)、關鍵功能細胞篩選研發平臺(“PROF-function”)及處方優化平臺(“PROF-formulator”)三個獨立體系的技術平臺。
界面新聞記者注意到,除了自主開發外,澤輝生物還和第三方合作來支持在研產品開發。其中包括公司內部產品開發活動中使用的若干許可引進的技術。
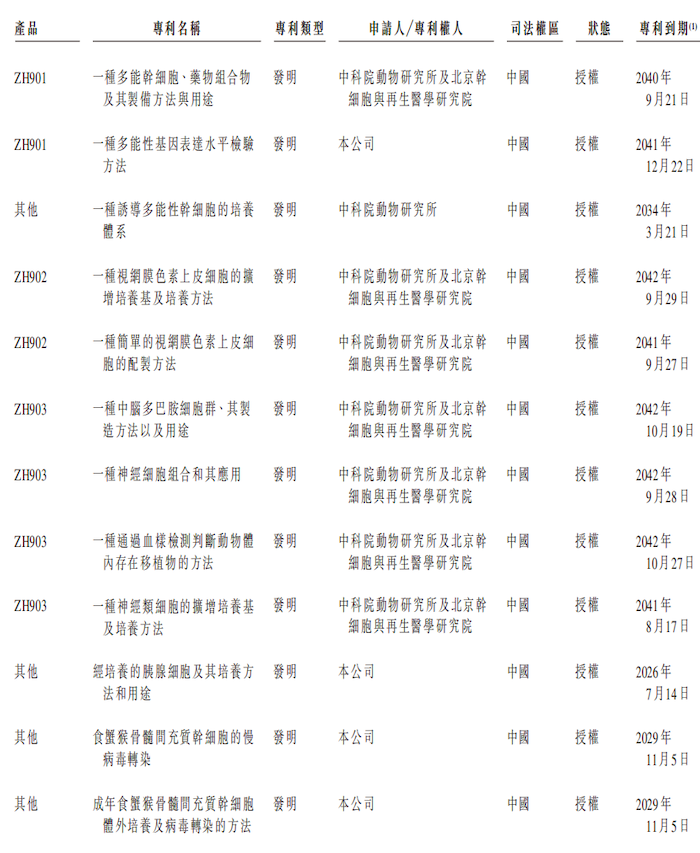
2019年至2024年9月,澤輝生物已經和中國科學院動物研究所和北京干細胞與再生醫學研究院訂立戰略合作協議及補充協議。
根據合作協議,對方為澤輝生物提供兩條臨床級人胚干細胞(hESC)系的排他性專利,以及M細胞、中腦多巴胺前體(mDAP)細胞及視網膜色素上皮(RPE)細胞的相關專利權在全球范圍的排他性專利,以研究、開發、生產要約銷售及商業化源自干細胞的針對所有潛在適應癥的治療產品。根據該協議,澤輝生物必須向合作伙伴支付包括首期付款、里程碑付款及特許權使用費付款等。

具體來看,2019年澤輝生物完成了購買M cells許可引進的專有技術,對價為1.00億元,2023年,公司完成了購買mDAP細胞及RPE細胞許可引進專有技術,每項許可引進的專有技術對價為1.00億元,共計3億元。
購買特定專有技術許可涉及長期付款安排(含融資),技術成本最初按協議中固定費用(主要是首付款)的折現值確認,里程碑付款作為無形資產的可變付款在產生時計入成本,而特許權使用費則根據治療產品的銷售額累計并確認為銷售成本的一部分。
截至2024年9月27日,澤輝生物擁有對公司業務重大的專利共計32項,其中20項專利仍未獲授權,剩余已獲授權的專利中,只有4項專利的專利權人為澤輝生物,其余項目的專利權人為中科院動物研究所及北京干細胞與再生醫學研究院。并且剩下的四項專利中,關于核心產品ZH901的相關專利只有1項。
研究面臨倫理挑戰
需要指出的是,hESC為一種存在于人囊胚的內細胞團中的PSC,囊胚是受精后第4至第7天發育胚胎的早期階段。在正常的胚胎發育過程中,其于第7天后消失,并開始形成三個胚胎組織層。
值得注意的是,用于新hESC系來源的胚胎是在父母雙方知情同意的情況下通過體外受精診所獲得。只有無法用于不孕治療的多余胚胎才能用于獲取hESC。然而,這種獲取通常需要破壞子宮外胚胎,此舉會引起倫理問題,在許多國家均為法律所禁止。
在中國,科學技術部及原衛生部于2003年發布的《人胚胎干細胞研究倫理指導原則》(“《指導原則》”)規定,通過體外受精、體細胞核移植、孤雌生殖或基因改造獲得的囊胚的培養期不應超過受精或核移植后的14天,但禁止對超過14天(或原條最早出現時)的胚胎進行的研究。
在美國,含有細胞的治療產品(包括PSC來源產品)被視為生物制品或醫療器械,并受到一系列政策的支持。雖然聯邦政府致力于促進干細胞療法產品的發展,但州一級的法律仍然存在分歧,一些州表示支持,而一些州則實施禁令。
在歐盟,基于細胞的治療產品(包括PSC來源產品)被視為需要監管批準的ATMP。這些產品必須遵守關于供體及細胞制備、儲存及轉移等流程的指令,并遵循ATMP的GMP指南。然而,歐盟尚未就成員國的干細胞研究發布一致的法規。
截至2024年9月21日,全球已有14種治療性干細胞來源產品獲得監管機構的批準上市,包括EMA、PMDA及MFDS。該產品均來自ASC,世界上尚且沒有獲準上市的PSC來源細胞療法產品,也沒有獲準在中國上市的干細胞來源細胞療法產品。中國有8種PSC來源細胞治療產品處于臨床開發。其中,澤輝生物的ZH901是中國首個亦為唯一一個源自hESC的干細胞來源細胞治療在研產品。