文|氨基觀察
創新藥就像挖礦,臨床數據是 “挖出來的是真正的礦”的證明,所有藥企都是靠這個證據去融資、BD、申請藥物上市。
因此,某種程度上,臨床數據是藥企最寶貴的財富。這也是為什么,生物科技行業極為重視知識產權保護,比如通過專利、著作權、商業秘密等方式對這些數據本身進行保護。
然而,專利能夠保護的僅是很少一部分,大量的具體試驗數據雖然不能申請專利,但對藥品審批來說又至關重要。最直觀的例子,莫過于仿制藥的注冊審批基于新藥的試驗數據,可以免于重新進行臨床試驗,從而大大節省時間和資金成本。
但對于原研藥來說,經歷“雙十”考驗獲批上市后,若專利保護期已屆滿或即將屆滿,且沒有額外的制度保護,那將意味著,其很難在有限的時間內收回成本,收益也就無從談起。這會極大降低藥企的創新、研發積極性。
倘若大量藥企的創新回報不及預期,整個行業的投資生態也將遭受沖擊。畢竟,投資最重要的是便是預期,沒有人愿意投資于自己無法掌控/預期的東西。
從這個角度來說,創新藥關鍵的知識產權不僅是專利,更包括藥品試驗數據保護(RDP)。因為,這可以防止競爭對手在一定時期內,利用自己的臨床數據申報仿制藥上市。
比如最早實行RDP制度的美國,其規定自生物創新藥上市日起,12年內FDA不得批準仿制藥的上市申請。其底層邏輯在于,誰做原始的安全性有效性數據,誰擁有數據的所有權,誰就應該得到相應的保護。
那么,藥品試驗數據保護到底是什么,為什么它比專利保護還要重要?
/ 01 / 攔截仿制藥的利器
眾所周知,新藥研發是一個風險高、投資大、周期長的過程,藥物有效性與安全性數據的獲得需要進行長期推進和不斷拓展的臨床試驗,并為此持續投入大量的人力與物力。
因此,如果對原研藥企業付出巨大代價取得的藥品試驗數據不加以保護,這會削弱原研藥企業的研發積極性,同時也會影響原研藥企業的持續研發投入,最終影響藥品的可及性。
藥品試驗數據保護制度起源于美國1984年通過的《藥品價格競爭和專利期補償法案》(《Hatch-Waxman法案》)。
這個法案首次明確提出了藥品“數據保護”,確立了針對藥品試驗數據的獨占保護制度。
FDA則在Hatch-Waxman法案之上,依據藥品注冊路徑的不同給予了新化學實體(NCE)、全新的生物藥實體(NBE)不同時長的保護周期。其中,NCE最長保護期為7.5年,NBE最長達12年,無論是NCE還是NBE,保護方式都為“不受理+不批準”,比如NBE上市4年內不受理仿制藥上市申請,4年后可以受理申請,但8年內不得批準上市。
簡單來說,所謂數據保護,就是監管機構在一定時間內不可以依賴原研公司提交的數據批準潛在的仿制藥品進入市場,直接延遲仿制藥進入市場的時間。
當然,在試驗數據保護期結束后,FDA只需要審查仿制藥是否與新藥具有生物等效性即可。
為了保護本土藥企,美國極力向其他國家推行該制度。作為國際協議,《與貿易有關的知識產權協議》(TRIPS協議)最早引入了藥品試驗數據保護制度,并成為了最早明確規定藥品實驗數據保護內容的國際標準。而后日本、歐盟等國家率先響應并積極實施,至今,全球已有多個國家以法律法規的形式對藥品試驗數據保護加以規制。
你可能會疑惑,藥企已經享有專利保護,為什么還要數據保護?
那是因為,只有專利是不夠的,知識產權保護需要貫穿創新藥的全生命周期,尤其是對于生物藥來說。
/ 02 / 額外的安全感
專利保護和數據保護,可以看做是兩種具有互補作用的知識產權保護方式,都有助于激勵開發創新藥所需的巨大投資。后者則為藥企提供了急需的額外安全感。
鑒于原研藥的臨床試驗充滿變數且耗時長久,當藥物最終獲批上市時,其法定專利保護期可能已經或即將結束。
在沒有額外保護機制的情況下,其他企業可以選擇開發、改良含有相同活性成分和相同適應癥的同品種藥品,并申請仿制藥的注冊。
對于前期投入成本巨大的原研藥企來說,這種情況將不利于其收回成本并獲得收益,進而可能降低原研藥企的研發積極性。
由于各國專利規則的不同,對于某一新分子實體,臨床實驗可以證明其安全性,但往往一個專利文件會有各種各樣的規定。特別是生物制劑相較于小分子藥物,更難以通過專利手段抵御生物類似物的挑戰。如果監管機構允許利用相同數據批準相似藥物,那么專利法所能提供的保護力度將大打折扣。
除了生成相關數據的成本高昂,生物技術發明專利保護資格的不確定性以及有效執行這些權利的能力也進一步凸顯了監管數據保護的必要性。
而數據保護則不同,藥企做出來的全套數據都會得到保護,仿制藥方做出來的數據也會得到保護。也就是說即使原研藥享有數據保護,也不會妨礙仿制藥獨立進行全部臨床試驗,獨立產生安全性有效性的臨床數據。這是數據保護和專利保護不同的地方。
當然,對于藥企來說,相比專利保護,數據保護最大的不同在于,其是在獲得上市許可之后才開始起算,期限和效力均十分明確,能夠有效阻止仿制藥依賴原研藥臨床數據獲得上市許可。
因此,從這個角度來說,RDP制度的重要目的之一,就是賦予原研藥在上市后對其原始數據享有一定期限的市場獨占期,通過不予批準其他企業利用未披露數據進行的仿制藥或新藥申請,為原研藥企提供額外的保護。
/ 03 / 穩定回報預期
2009年7月,美國國會召開聽證會,研究美國生物制劑的12年監管數據保護期的立法提案。第二年,《生物制劑價格競爭和創新法》簽署成為法律,從美國監管機構首次批準之日起,新生物制劑的數據排他性為期12年。
可以說,除了自由定價,正是對于知識產權的全方位、嚴密保護,造就了美國生物科技行業的蓬勃與繁榮。
底層邏輯在于,這讓大量VC/PE看到了未來回報的預期。
風投資金對于生物技術行業至關重要,而如果看不到未來的回報“承諾”,投資機構沒有理由投資于這樣一個高成本、高風險的行業。這種“承諾”,一方面取決于藥企的研發實力,機構的投資能力,另一方面則有賴于制度保護。
知識產權保護,包括專利和數據保護,是創新藥企的根基,也是投資的基礎。沒有人愿意投資自己無法掌控/預期的東西。
對于投資者來說,底線很簡單:如果生物技術公司的臨床數據在合理的時間內受到保護,它們更愿意加入這場賭局。
因為,它們往往根據隨著時間的推移的回報率來證明其合理性。而獲得的回報,則取決于投資的持久性——換句話說,創新藥將產生多長時間的現金流和利潤。
這種情況下,監管數據保護至關重要。因為正如前文所說,專利法在某種程度上為藥企提供了這種保護,但并不完全。
而在一些投資人士看來,當前趨勢還在發生變化,由于一些最高法院的其他裁決,專利法今天提供的保護更少。因此,在他們眼中,數據保護變得更加重要。
刨除美國訴訟的天文成本,對于初創公司,監管數據保護在實踐中非常重要,因為你不能指望能夠通過漫長的專利訴訟,來維護自己的權利。
簡單來說,專利和RDP在內的產權保護,不僅讓創新藥企,也讓行業的另一重要參與者——投資機構,對于創新藥這門生意的投資回報,預期變得更加穩定。
/ 04 / 是否破壞了藥物的獲取?
當然,市場也擔憂,RDP通過延長新藥享有的市場排他性期限,會讓藥企變得更加壟斷,進而影響藥物的可及性,并會將醫療保健成本推高到不可持續的水平。
然而,日內瓦網絡的研究表明,這種擔憂或許是沒有根據的。比如加拿大和日本子,它們近年來都延長了各自的RDP期限,但數據顯示,在變化之前和之后的幾年里,國家藥品支出占GDP的百分比仍然幾乎持平。
另外,有機構統計53個國家的市場數據后,的除了RDP反而能夠增加創新藥物的可及性。
2018-2022年,全球推出的所有創新藥物中獲批創新藥物的比例,具有RDP的市場平均在全球至少一個市場擁有31.5%的創新藥物,而沒有RDP的市場平均有11.1%的創新藥物可用。
這意味著,RDP市場中的患者可及的創新藥物數量是沒有RDP市場的患者的3倍左右。
造成這種差異的原因之一是,與其他知識產權保護機制一樣,RDP加強了藥企在一市場推出創新藥物的立項依據。因為藥企將有更好的機會享受一段保護期,在此期間它們可以產生收入,以收回開發和推出創新藥物的成本。
此外,數據顯示,在有RDP的市場上進行了更多的臨床試驗。比較在有和沒有RDP的市場進行的平均臨床試驗數量,發現有RDP的市場平均每百萬人有21項臨床試驗,而沒有RDP的市場平均有4項。
這一數據也能夠說明,RDP正向激勵了創新藥物臨床研發。
而在業內人士看來,實施RDP也有可能會鼓勵更多的“創新”。核心在于,數據保護提供了另一種形式的知識產權保護,會推遲生物仿制藥公司將產品推向市場,除非它們自行取得的證明藥品安全性、有效性的試驗數據。
/ 05 / 國內何時跟上
如下圖所示,全球擁有高度創新的生物制藥行業的主要市場,基本擁有強大的知識產權保護和執法體系。美國對于創新生物制劑的數據保護期為最長達12年,歐盟采取“8+2+1”的保護模式,日本對創新藥的保護期由6年延長至8年,加拿大則采用“6+2”的保護模式。
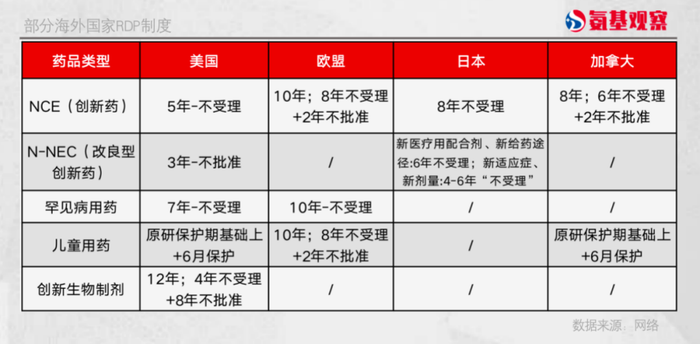
回到國內來說,隨著創新藥領域的大步發展,監管已經在最新的《專利法》修正案中加強了對創新藥的知識產權保護。然而與國際水平相比,國內醫藥創新知識產權保護體系仍有待完善,數據保護具體條例還有待進一步落地。
事實上,早在本世紀初加入WTO后,我們國家便簽署了TRIPs協議,并2002年實施的《藥品管理法實施條例》中引入了相關數據保護內容。但截至目前,仍處于有總體規定、無實施細則的狀態。
真正的改革、完善序幕應當是始于2018年,藥監局出臺《藥品試驗數據保護實施辦法(暫行)(征求意見稿)》,系統性制定藥品試驗數據保護制度向社會公開征求意見;2022年5月,藥監局綜合司發布“公開征求《中華人民共和國藥品管理法實施條例(修訂草案征求意見稿)》意見”,將數據保護期統一設立為藥品注冊上市后6年。
同年7月,藥監局在回復人大代表的相關提案中表示,待《藥品管理法實施條例》修訂實施后,將按照立法程序和要求,統籌安排《藥品試驗數據保護實施辦法(暫行)》工作進展。
期待相關制度能夠早日頒布實施,進一步完善我國醫藥行業的知識產權保護環境。


