6月13日,IQVIA發布《2024全球腫瘤研發趨勢》報告,顯示創新藥物的不斷上市是推動不同腫瘤藥物增長的主要動力之一。目前,乳腺癌、非小細胞肺癌、多發性骨髓瘤、前列腺癌和腎癌的治療藥物合計占到所有腫瘤藥物銷售額的56%。
其中多發性骨髓瘤(MM)領域的增長極大地推動了血液腫瘤總支出的增長,其驅動因素是新型療法的供應和使用增加,由于傳統療法的生存率仍然很低,新型療法的療效要顯著優于傳統療法。
MM百億市場群雄逐鹿,CD38突圍而出
多發性骨髓瘤是血液系統的第二大常見惡性腫瘤,由于這一腫瘤無法治愈,大部分患者仍然會經歷復發,因此在進程上大致會分為新診斷多發性骨髓瘤(NDMM)以及復發或難治性多發性骨髓瘤(RRMM)。復發性多發性骨髓瘤是指癌癥在治療或緩解期后復發。難治性多發性骨髓瘤是指癌癥治療無效或不再有效。
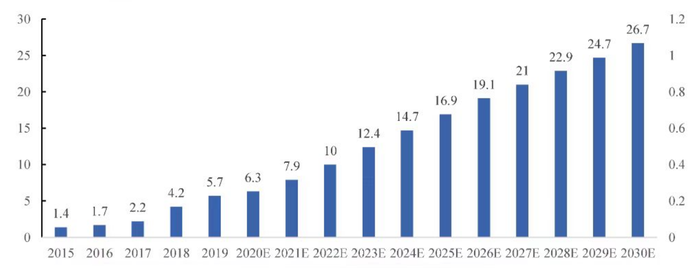
據Frost & Sullivan 預計,全球MM 治療市場將于2024年達到395億美元并在2030年達到473億美元;中國MM治療市場的規模將于2024年及2030年分別達到147億元人民幣及267億元人民幣。面對這樣一個“百億級別”的市場及巨大的未被滿足的臨床需求,國內外藥企爭相布局研發多發性骨髓瘤新藥。
根據藥融云數據庫,截至目前,全球以多發性骨髓瘤為適應癥進行開發的管線共926條,處于藥物發現階段共436條,管線豐富。從管線靶點布局來看,BCMA因其CAR-T及雙抗產品臨床數據出色,全球藥企布局管線數量最多,CD38、CD3、GPRCD等靶點布局管線同樣體現出臨床數據潛在競爭力,較為集中。
數據顯示,2023年全球MM藥物市場以CD38單抗為主的靶向療法占比高達46.4%,蛋白酶體抑制劑、免疫調節劑和BCMA靶向療法占比分別為42.4%、6.2%、4.5%,過去十年間CD38單抗迅猛增長,其他創新療法逐步嶄露頭角。
CD38單抗能夠擁有如此迅猛增速,與其核心機制獨特性密不可分。CD38是一種兼具受體和外切酶活性的II型跨膜糖蛋白,參與細胞黏附與跨膜信號傳導過程。在正常的淋巴細胞、髓系細胞及非造血組織細胞中,CD38分子表達水平較低;但在多發性骨髓瘤患者的惡性腫瘤上表達達到80-100% ,這一高度且均勻的表達特性使得CD38成為理想的多發性骨髓瘤治療“皇冠靶點”。
在CD38這個賽道,國內外巨頭也正“群雄逐鹿”,目前全球上市的已有兩款,分別為強生旗下的Daratumumab,以及賽諾菲旗下Isatuximab。而在近期美國臨床腫瘤學會(ASCO)年會和歐洲血液協會(EHA)年會上,賽諾菲旗下的CD38單抗Isatuximab接連公布兩項研究,分別是針對不適合移植的NDMM患者的IMROZ 3期臨床研究,以及針對中國RRMM患者的真實世界研究,為在當前競爭火熱的MM領域再添熱度。在此之下, MM治療格局勢必又將迎來一輪新的改變。
PFS與MRD數據加持,CD38家族Isatuximab沖擊一線療法
相關數據統計,每年全球多發性骨髓瘤的新診斷患者超過18萬人 。根據Frost and Sullivan估計,2023年中國多發性骨髓瘤的患病人數大約為15.3萬人,新發病例數為2.32萬人,預計患病人數將于2030年增長至26.63萬人。
由于目前多發性骨髓瘤仍然不可治愈,隨著后線治療,緩解深度更低,無治療間隔時間更短,嚴重影響患者的生存獲益。因此,對于新診斷多發性骨髓瘤患者而言,一線治療在整個治療過程中占有極其重要的地位。
因此,一線也成為了MM領域“兵家必爭之地”,同時MM療法都在往前線布局沖刺。然而,盡管目前已有多種新療法和新藥物的應用,靶向BCMA、XPO1、GPRCD針對MM獲批的療法中,暫未有一款獲批一線治療方案,大都集中在3/4線或以上的RRMM患者。
在ASCO年會上,賽諾菲公布的Isatuximab聯合療法在NDMM患者中的最新數據展現了其在一線“同類首創”的潛力。在一項名為IMROZ的3期臨床中,與硼替佐米、來那度胺和地塞米松(VRd)的標準治療并以Rd進行維持治療相比,Isatuximab與VRd的聯合使用,并以Isa-Rd維持治療對不適合移植的新診斷多發性骨髓瘤患者而言,可顯著降低40%的復發或死亡風險。在60個月時,使用Isa-VRd治療的患者預估PFS為63.2%,而使用VRd治療的患者為45.2%。據外媒報道,根據目前趨勢,預計Isa-VRd的中位PFS將達到90個月左右,有望成為這類患者一線治療新標準。

值得一提的是,MRD陰性完全緩解的次要終點。在MM治療領域,實現不可檢測的微小殘留病(uMRD)是提倡達到的初步目標之一,尤其是對于高危MM患者,達到深層次緩解更為關鍵,這促使轉換為更長的PFS和OS,對MM患者的動態危險分層和指導治療具有積極作用。
法國里爾大學醫院血液科教授,法國醫學科學院院士,IMROZ主要研究者Thierry Facon介紹:“IMROZ結果展示了Isatuximab成為一線治療‘支柱’前景,可能改善多發性骨髓瘤這一無法治愈疾病的長期預后。”
目前,美國食品藥品監督管理局(FDA)已經基于該研究,授予Isatuximab優先審評資格,用于與VRd聯合治療不適合移植的新診斷多發性骨髓瘤患者。歐盟(EU)的相關申請也在審評過程中。如果成功獲批,Isatuximab將成為首個與標準治療聯合使用,用于治療不適合移植的新診斷多發性骨髓瘤患者的CD38單抗。在中國,該項適應癥也已經遞交上市申請,并獲國家藥品監督管理局(NMPA)受理。
創新藥物的創新通道,真實世界數據有望加速RRMM格局變化
由于MM的復發性特點,隨著疾病的進展,每次復發的侵襲性都會增強,而新療法獲得的緩解期也逐漸縮短。同時,在相關診療方案中,復發后需要換用新機制藥物,避免重復,產生耐藥性。因此,除了一線方案必須盡量拉長首次復發時間、延長PFS外,后線治療的創新療法的“廣度”也非常重要,以避免患者后期無藥可用的情況。
根據PDB樣本醫院數據,2023年中國MM市場中,免疫調節劑占比為36.9% 。在以來那度胺(R)為核心的聯合療法中,耐藥性等問題產生就需要更多的創新選擇。特別需要注意的是,與西方國家相比,我國多發性骨髓瘤患者在診斷時已達晚期的比例更高,高危患者數量更多,對于創新療法的需求也更為迫切。
今年歐洲血液協會(EHA)年會期間,賽諾菲公布了在中國海南博鰲樂城國際醫療旅游先行區開展的一項真實世界研究(IsaFiRsT)最新進展。IsaFiRsT研究是首個評估Isatuximab與泊馬度胺和地塞米松的聯合療法(Isa-Pd),在中國復發或難治性多發性骨髓瘤患者中有效性與安全性的真實世界研究,且作為創新藥物注冊研究。研究主要終點為客觀緩解率(ORR),次要終點包括PFS、總生存期(OS)、緩解持續時間(DoR)和安全性。
截至2023年11月12日,研究者評估的ORR為82.6%,與全球III期ICARIA-MM研究結果一致。至首次緩解的中位時間為1.18個月(范圍為0.9-3.1個月)。中位隨訪8.41個月時,未達到中位PFS、OS和DoR。此外,未發現新的安全性信號,整體不良反應可控。
除了數據表現,其“真實世界研究”的身份也引人注目。近年來,為促進國際先進藥品及醫療器械盡快進入中國市場惠及患者,NMPA積極探索將真實世界數據(RWE)應用于藥械產品的審評審批。
瑞金海南醫院用時僅238天快速推進完成Isatuximab真實世界研究項目,其上市申請于2023年12月已正式獲得NMPA受理,成為首個利用樂城真實世界數據獲NMPA受理上市許可申請的血液腫瘤治療藥物。
賽諾菲Isatuximab在一線及后線多發性骨髓瘤的布局與推動上市加速目前來看已經箭在弦上,通過與標準治療聯合使用搶占一線先機,并以真實世界研究創新通道加速中國市場進度,帶來RRMM創新選擇。而賽諾菲在MM領域的目光卻瞄準了更遠、更廣闊的版圖。其正在開展包括GMMG-HD7、ISKIA、IRAKLIA等多項3期臨床研究,覆蓋不同治療組合、不同適應癥范圍、從靜脈注射到皮下的完整版圖。隨著這顆CD38皇冠靶點的“新明珠”獲得持續突破,CD38是否能持續引領MM市場,我們將拭目以待。
