文|動脈網
從幾個月前全國兩會首次將創新藥寫入《政府工作報告》開始就可以預見,2024將不會是普通的一年。
2024年以來,已有山東、海南、江蘇、北京等省市,以及廣州、珠海、海口、溫州等城市相繼出臺創新藥支持政策,據不完全統計,已涉及全國13個區域,覆蓋范圍廣、支持力度大、落地速度快。
例如,北京、廣州和珠海三地在同一天內發布新政,成為行業熱議焦點。其中,4月7日北京在征求《北京市支持創新醫藥高質量發展若干措施(2024年)》的意見時指出,因時間緊急,公開征集意見時間縮短為3個工作日;10天后,這則文件便正式印發。
接踵而至的新政,已成為2024及未來數年的行業風向標。
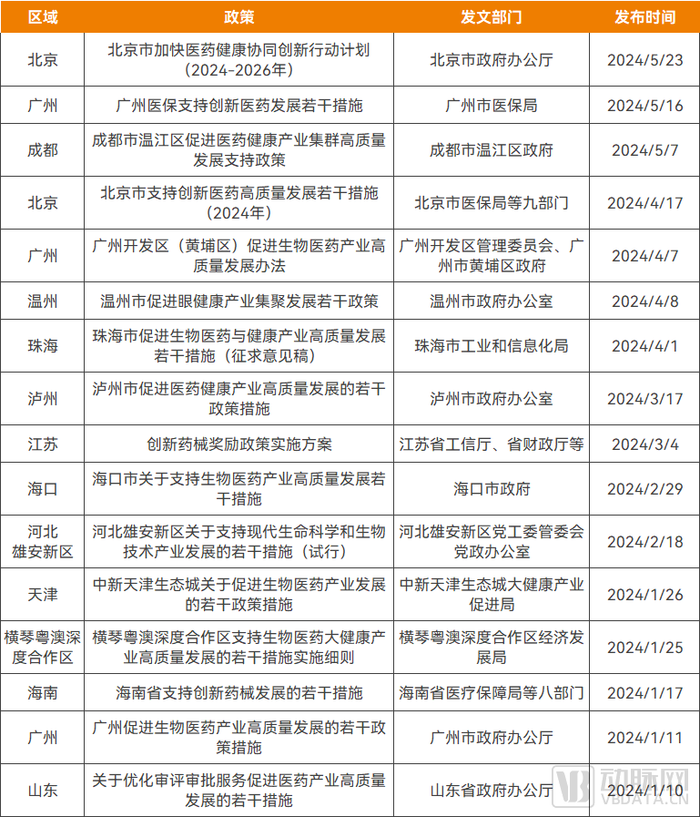
2024年以來全國范圍內出臺的部分創新藥支持政策,資料來源:各地政府官網

最高獎勵50億元,多地爭搶創新藥項目
2024年《政府工作報告》指出,要積極培育新興產業和未來產業,其中就包括加快前沿新興氫能、新材料、創新藥等產業發展,積極打造生物制造、商業航天、低空經濟等新增長引擎;創新藥同時也被納入了具有生產力躍遷意義的“新質生產力”范疇。
頂層設計需要以具體措施來落地。在鼓勵生物醫藥發展的措施中,最直接的就是資金扶持、獎勵或補助。2024年,多地政策均制定了對藥械創新項目或企業的扶持、獎勵辦法,金額從幾十萬至數十億元不等。

各地創新藥新政制定的部分獎勵辦法,資料來源:各地政府官網
在研發環節,各地對創新成果轉化、臨床試驗等,通過資金獎勵、投資入股、貼息貸款等形式予以支持。
廣州對具有全球影響力的大師、戰略科學家領銜的具備顛覆性技術創新突破、應用前景明確廣闊的若干生物醫藥頂尖項目,在項目科技研發、成果轉化和產業化階段,按“一事一議”原則,最高支持額度50億元。
2023-2025年,山東對在省內轉化1類創新藥完成Ⅰ、Ⅱ、Ⅲ期臨床試驗的,經評審給予不超過研發投入40%,最高分別為1000萬元、2000萬元、3000萬元資金支持,每個企業每年累計最高1億元。
在創新成果上,各地通常對獲得創新藥、創新器械注冊證的產品予以獎勵;其中,1類新藥、通過特別審查程序的三類器械能獲得更豐厚的獎勵,一個品種高達上千萬元。
醫藥工業是工業體系的重要組成部分,對地區稅收、就業及產業鏈完善有重要價值。因此,在生產制造環節,各地大力支持CDMO/CMO企業發展,以及引導創新藥械企業進行本地生產。
河北雄安新區對CRO、CDMO/CMO、CSO等公共服務平臺,按經評審核定項目總投資的20%給予資助,最高達5000萬元。海口對醫藥企業新取得國家藥品注冊批件后,24個月內落地本企業生產的,按藥品品種和劑型分類,給予一次性獎勵,其中1類新藥獎勵3000萬元。
引進外地產品至本地生產也是重要策略之一。例如,海口鼓勵醫藥企業從本市以外地區購買、轉移、引進藥品生產批件并在本企業生產。廈門支持企業購買轉化境內外科技成果,對購買生物醫藥重大科技成果在本市實現產業化的企業,按不超過實際支付技術交易額的30%予以補助。
優化對獎勵或扶持項目的審評審批流程,也是2024年諸多政策中的一大亮點。
盡管各地積極對創新藥產業予以“真金白銀”的支持,但大多屬于情況下,需要企業按政策要求進行申報,經過層層審批后,符合條件的才能獲得相應資金。
2024年,江蘇首次探索省級財政資金“免申即享”,即對符合條件的創新藥企業,取消以往企業申報、組織專家評審、進行遴選公示一系列環節,直接進行獎勵。本次獎勵涉及20家企業,支持26個創新藥械,包含8個創新藥、9個改良藥、9個創新醫療器械,共安排1.66億元獎勵資金。這一措施為企業帶來了極大便利,也提升了企業創新積極性。
總的來說,各地創新藥鼓勵政策整體呈現這樣的路徑:吸引創新研發項目,大力推進本地創新成果轉化,引入外地項目至本地生產,且這幾條主線同時并行。
各地偏愛哪些細分領域?
高特佳投資副總經理于建林談到,在政策加持、資本市場發展、人才引進、國內需求等因素促進下,中國生物醫藥過去10年來處于快速增長期,已成為全球第二大醫藥市場,在研新藥數量也位居全球第二。
“全球創新市場中,中國生物醫藥從原來的跟隨者逐步成長為并行者,某些領域甚至已經領跑;在一些新興賽道,如基因檢測、創新疫苗、新型抗體、細胞治療等領域,我們已經形成了比較優勢。”于建林表示,“但不可否認,產業確實遇到一些問題,比如基礎理論、底層關鍵技術欠缺,生物信息資源積累不夠,原始創新能力薄弱。”
拆解2024年以來的新政可以發現,原始創新以及為之提供支撐的基礎研究越來越受到重視;細胞和基因治療、合成生物學、腦科學、特醫食品等各地積極布局的熱門領域,盡管大家都想爭奪好項目,但也并非都在同一熱門賽道上內卷,而是結合已有產業基礎和優勢資源,有傾向性地鼓勵重點或特色細分領域。
北京頂尖高校和科研機構林立、科學家聚集,且在前沿技術領域已有眾多創新成果。憑借這些基礎,北京未來將聚焦關鍵的疾病或技術領域,進行基礎研究和應用研究的進一步突破。
按照《北京市加快醫藥健康協同創新行動計劃(2024-2026年)》,北京將在退行性疾病等領域重大科學問題和關鍵技術的研究突破;在細胞基因治療、腦機接口、合成生物學等前沿技術領域催生具有顛覆性、引領性的科學發現和技術突破;支持腦認知原理解析、衰老機制等前瞻性重大科學問題的基礎研究等等。
醫學檢驗是廣州重點產業之一。得益于入局時間早,政策支持和企業創新正向循環,廣州醫學檢驗領域已跑出了金域醫學、達安基因等頭部公司,形成了廣州國際生物島、廣州科學城等產業集群,產業鏈圍繞醫學檢驗服務,完整覆蓋至上下游的外診斷試劑設備研發制造、病理診斷、數據服務、冷鏈服務等。
近年來,在精準醫療趨勢下,臨床實驗室自建項目(LDT)將成為醫學檢驗的重要組成部分。我國LDT尚處于極早期。
早在2022年,廣州就已提出探索LDT模式的規劃。2024年,《廣州促進生物醫藥產業高質量發展的若干政策措施》再次明確,將分批次開展實驗室自建檢測方法(LDT)體外診斷試劑試點;鼓勵有條件的醫療機構聯合LDT領域重點企業,對國內尚無同品種產品上市,且有重大臨床需求、技術成熟、風險可控的體外診斷試劑,開展LDT試點;未來形成可在全市范圍復制推廣的制度性創新成果。
借助對LDT的大膽嘗試,廣州在醫學檢驗及上下游產業的發展規模將進一步壯大。
繼博鰲樂城國際醫療旅游先行區之后,數字療法成為海南重點支持的新領域。過去兩年里,海南圍繞數字療法在臨床試驗、審評審批、產品推廣應用、行業交流等諸多方面動作不斷,成果也頗豐。
2024年,《海南省支持創新藥械發展的若干措施》提到,將加快數字療法醫療服務價格項目的立項,完善數字療法價格形成和醫保支付機制,將數字療法與DRG/DIP醫保支付方式改革相結合,發揮數字療法在醫療成本管控作用和加快健康管理中的應用。
與對其他藥械創新產品的支持方式相似,海南對數字療法的實際有更具體的做法。例如,《海口市關于支持生物醫藥產業高質量發展若干措施》鼓勵醫療機構使用數字療法產品,對設立數字療法診療中心的醫療機構一次性獎勵10萬元。醫療機構使用本市企業生產的數字療法產品進行診療的,按首次采用的批件數量給予獎勵,一個批件獎勵20萬元,單個醫療機構獎勵每年合計最高不超過100萬元。
在全球數字療法都還在驗證產品臨床價值及商業化路徑的今天,海南對數字療法支持的力度體現了其力求引領全球創新的決心。
當然,此處列舉的幾個城市和細分領域只是冰山一角。可以肯定的是,各個城市的細分領域側重點既有一脈相承,也力求不斷開疆拓土,尋找新的增長點。
如何幫助企業“賣貨”?
自藥審改革以來,經過近十年時間的發展,我國創新藥陸續步入收獲期。2020至2023年,國內每年分別批準47款、21款、40款創新藥。伴隨著產品密集獲批,商業化問題隨之而來。
“當前,醫院受到藥占比、結余留用等考核限制,面臨DRG/DIP支付改革壓力,創新產品進入醫院面臨較大挑戰。”于建林認為,在支付環節,我國支付體系以醫保為主,商業保險尚未充分發展起來,患者接受度也有待提升;在醫保保基本和控費基調下,創新藥、創新器械的價格還未與其價值充分匹配。
2024年的新政中,北京、海南、廣州等地分別由醫保部門參與,與衛健、藥品監管、金融監管等部門協同,對創新產品在定價、進院、醫保支付、商業健康險供給等方面提出了支持措施。
其中,海南將建立新批準創新藥械進入市場的首發價格形成機制:堅持企業自主定價原則激發創新活力,引導企業合理定價,完善全周期價格管理監督。北京則提出,對創新技術項目優先啟動統一定價論證程序,同步研究納入醫保支付。
另一則更高層級的文件也指示了未來創新藥定價機制的方向之一。2024年1月,由中共中央辦公廳、國務院辦公廳印發《浦東新區綜合改革試點實施方案(2023-2027年)》提出,依照有關規定允許生物醫藥新產品參照國際同類藥品定價,支持創新藥和醫療器械產業發展。
在進院環節,多地采取的主要做法是為創新產品設置“綠色通道”,實現快速掛網;并將創新產品涉及的藥品或治療費用單列結算,不納入DRG/DIP;創新藥械的使用也不受相關考核項目的限制。通過這些政策,醫療機構將有更足的動力以臨床需求為導向來使用創新產品。
在支付環節,國家醫保局近幾年來大力推進新藥及時進入醫保目錄,各地在進一步促進醫保支付政策落地的同時,將商業健康險作為重點拓展渠道。
北京、廣州等城市企業數量多,當地醫保部門鼓勵企業建立補充醫療保險,利用補充醫療保險費用從成本中列支的優惠政策,支持購買覆蓋創新藥械的補充醫療保險產品。
針對商業健康險產品開發最稀缺的醫療與醫保數據資源,北京和海南兩地鼓勵探索醫療健康數據與商業健康保險的信息共享機制,推動基本醫療保險平臺與商業保險公司共享數據,以推進數據在商業保險產品開發與理賠中的合規應用。
事實上,2023年,上海市醫保局就已與當地衛健、金融監管等部門共同制定了《上海市進一步完善多元支付機制支持創新藥械發展的若干措施》,著力打破創新產品在商業化道路上的一系列瓶頸。
2024年3月,上海對外公布了上述政策的進展情況:新政落地有力推動了生物醫藥產業,2023年產業規模達9337.32億元,同比增長4.9%,治療性生物制品、植介入器械、醫療影像設備等細分領域的高端制造業增長較快。
此外,2023年上海醫療機構采購國談創新藥金額108億元,同比增長了73.1%。以一家注冊在上海的靶向創新藥物研發企業為例,該企業自主研發的兩款1類新藥成功續約國家醫保目錄,并納入上海市生物醫藥“新優藥械”產品目錄;新政落地后,兩款產品已在多家市級醫療機構使用,2023年下半年在上海市場的銷售金額同比分別增長36%和105%。
商業化進程直接影響著創新企業是否能填補研發成本,是否有資金支持更多產品研發。目前,上海支持創新藥械商業化的做法已見成效,其他新政是否也能達到立竿見影的效果?值得期待。
儲備一批上市公司
有了產品全生命周期的難題解決方案后,創新藥還面臨的另一大難題是缺錢。當前,一級市場融資難、IPO通道收窄、投資機構退出難等現狀并存,且這幾種因素又相互交織影響,造成了資本寒冬。
前文提到,各地重金投入、獎勵創新。然而,創新僅依靠補貼還遠遠不夠,必須依賴市場化的資金。
2024年各地出臺的鼓勵政策中,也包含了對創新藥資本市場的支持。
廣州鼓勵支持政府引導基金在生物醫藥領域“投早投小投創新”,鼓勵各類政府出資的科創母基金、市屬國有企業私募股權基金、創投基金等提高對早期生物醫藥項目的投資比例,重點投向種子期、初創期科技創新企業或項目。
北京也推動更多資金投早、投小,以北京市醫藥健康產業投資基金帶動社會投資;做好企業上市儲備,2024年重點做好10家企業上市儲備和服務,計劃在2024年至2026年新增20家上市企業。
“生物醫藥高風險、高投入、時間長,融資貫穿了企業發展壯大的全過程,即使公司上市了,仍然不斷進行管線引進、產業并購,需要進行持續的再融資。多層次的資本市場對行業發展有舉足輕重的作用。”于建林表示。
針對二級市場,2024年證監會一方面再次明確了科創板未盈利企業上市的相關事項,一方面修改了《科創屬性評價指引(試行)》,提高對擬上市企業在研發投入、發明專利數量及營業收入復合增長率方面的要求。
新政更加聚焦于對真正意義上創新企業的篩選,短期內呈現出上市通道收窄的現狀,長期則有助于真正優秀的企業上市募資,并借助后續融資獲得進一步發展。
因此,即使有各地各類創新藥政策的鼓勵與扶持,許多企業和投資機構依然要承受上市環境變化帶來的陣痛;在這個大背景下,企業需建立多元化的資金來源,投資機構需探索多元化的退出通道。
2024年3月,網上曾流傳一份由國務院部門起草的《全鏈條支持創新藥發展實施方案(征求意見稿)》,文件瞬間在業內掀起波瀾,它被認為是繼藥審改革之后,國家對創新藥支持力度最大的政策。到目前為止,盡管該文件并未公開發布,但綜合前文對全國各地創新藥政策的解析來看,全鏈條支持創新藥的舉措已初具雛形,甚至在部分地區已經落地。
當前,國內創新藥政策體系已趨于穩定和完善,展望未來,“創新”將成為更長遠的關鍵詞。
在于建林看來,以往國內做創新,那些研發周期相對較短、風險較低、投入較少的跟隨性創新比較受歡迎;2024年,隨著新一批政策相繼出臺落地,創新藥全鏈條獲得支持,源頭創新時代或許正在開啟。



