文|動脈網
溶瘤病毒療法能夠特異性地在腫瘤細胞內復制并造成腫瘤細胞裂解而不影響正常細胞,具有復制高效、殺傷效果優良和毒副作用小等特點,曾被視為癌癥治療的“里程碑”,但多年以來的臨床試驗都不算順利。
近期,一項小型3期試驗的積極臨床結果讓溶瘤病毒領域再次掀起希望的波瀾。12月初,CG Oncology宣布FDA已授予其溶瘤病毒療法CG0070快速通道指定和突破療法認定,這是一種膀胱內給藥的溶瘤病毒療法,臨床3期試驗的中期分析結果顯示,75.5%可評估療效的患者在任何時候都達到了完全緩解。
業界評論其“可能撼動溶瘤病毒世界”,甚至表示“可能成為在美國獲批的第二個溶瘤病毒療法”。
中后期成果有所收獲之外,溶瘤病毒領域今年也有不少早期研究進入臨床,如美國FDA批準了兩種更具創新性的、以新型嵌合病毒為基礎的溶瘤病毒療法進入IND,嵌合病毒可自主優化組合、表達對抗腫瘤免疫起關鍵作用的細胞因子或信號分子;國內也有多家企業獲得批件,進入臨床階段的溶瘤病毒研究數量大幅增加,其中不乏中美雙報項目。
在今年國內的一些溶瘤病毒會議中,能明顯從人頭攢動的現場感受到參會熱情的提升。有從業者表示:“這幾年下來,大家對溶瘤病毒療法的認知更深了,安全性和接受度較以前有很大提高,PI也持更加積極的態度。新機制、新靶點不斷涌現,國內源頭創新充足,國家政策支持力度也大,可以說是充滿希望的。”

溶瘤病毒已有百年歷史,但唯一在世界范圍獲廣泛認可并且通過FDA批準的溶瘤病毒是安進的Imlygic。FDA自2015年批準Imlygic后,便再也沒有批準一款溶瘤病毒產品。其他四款在不同國家地區上市的藥品分別為賽百諾的今又生、Latima的Rigvir、三維生物的安柯瑞以及第一三共的Delytact。
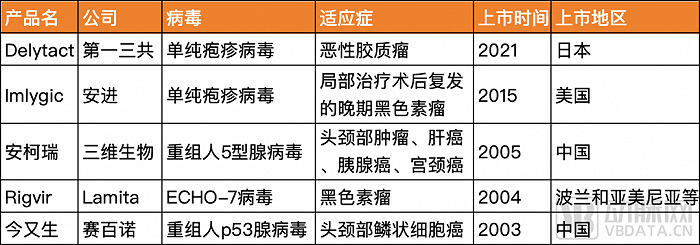
沙利文數據顯示,預計2025年全球溶瘤病毒市場規模達到67.9億美元,2020~2025年復合年增長率為171.2%;2025年中國溶瘤病毒市場規模達到10.4億美元,2020~2025年復合年增長率為213.4%。
2023年對溶瘤病毒來說,是黎明嗎?
美國明星公司倒下,國內百花齊放
對溶瘤病毒領域來說,今年的一大噩耗是美國溶瘤病毒明星公司Oncorus的倒下。Oncorus誕生于FDA首肯溶瘤病毒的2015年,股價曾一度超越35美元/股,公司市值接近10億美元。Oncorus還曾與默沙東合作,評估核心管線ONCR-177針對晚期和/或復發性皮膚、皮下或轉移性淋巴結實體瘤患者的與K藥聯用效果。
但Oncorus的研發進展緩慢,ONCR-177和K藥聯用的1期臨床結果不盡如人意,隨后這條管線被砍,剩下的3條研發管線直到公司在今年6月宣布解散時,也還未進入臨床1期。
Oncorus的技術路線較為復雜,旨在利用LNP將能夠編碼病毒的RNA(vRNA)遞送至腫瘤細胞,并在腫瘤細胞中進行復制擴增,從而殺傷腫瘤細胞。既是溶瘤病毒,也是RNA藥物,被稱為靜脈給藥自我擴增RNA藥物。
在大環境不佳的2023年,這樣一家前路不明、產品缺乏說服力的公司倒閉,也是一種必然。
與此同時,大洋彼岸的中國在溶瘤病毒領域百花齊放,國內布局的企業近50家,今年收獲頗豐。
國內溶瘤病毒企業的管線模式分為License-in和自主研發。例如樂普生物、恒翼生物、阿諾醫藥與國外企業合作開發的溶瘤病毒候選產品,均已進入臨床3期試驗階段。其中樂普生物引進了前文中CG Oncology的CG0070。
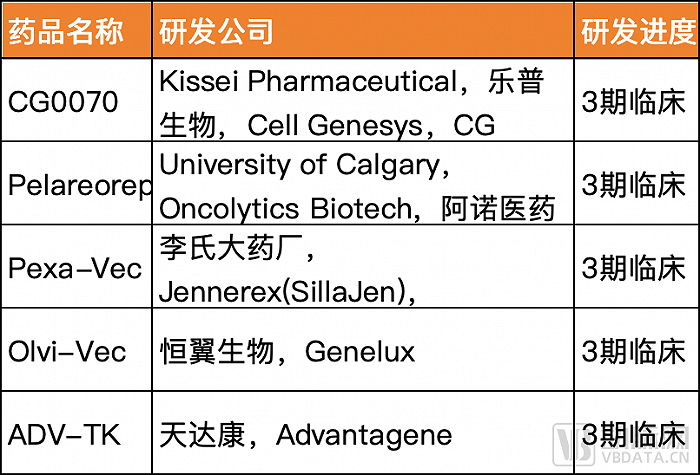
自主研發的溶瘤病毒產品也在快速推進,公司以濱會生物、復諾健、亦諾微、康萬達等為代表。這些公司的共同特點是公司創始人都對皰疹病毒、腺病毒做了多年的科學研究。其中濱會生物的BS001針對黑色素瘤試驗已在中國進入臨床3期。
今年可以看到有近15款國內自主研發的溶瘤病毒產品新獲臨床批件,病毒類型多樣,其中不乏靶點創新以突破現有瓶頸的潛在“first-in-class”創新藥。
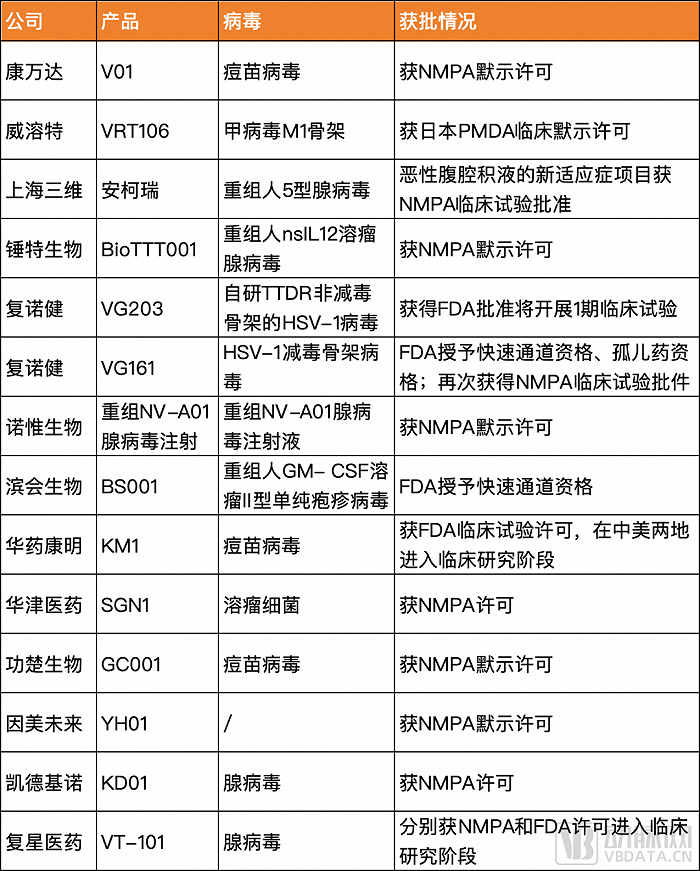
更值得關注的是,今年6月,復諾健生物研發的用于治療晚期肝細胞癌的溶瘤病毒產品VG161,以及濱會生物研發的BS001用于治療抗PD-1單抗治療后耐藥或進展的不可切除的Ⅲ期或IV期黑色素瘤,接連被FDA授予快速通道資格。這意味著兩家公司將在后續的溶瘤病毒藥物研發與審評過程中,獲得更多與FDA溝通交流的機會;還可以在提交NDA或BLA時,向FDA滾動遞交新藥研究資料。
緊接著,濱會生物在8月初正式啟動A股上市輔導。一系列溶瘤病毒公司在研發或商業上的進展,預示著中國溶瘤病毒領域可能將進入新的熱潮期。
聯合療法“升級中”
溶瘤病毒是現貨型的治療手段,針對特定癌種的治療制劑不存在個性化差異,其安全性問題和作用機制與其他療法并不重疊,所以時常被考慮加入到聯合療法當中。
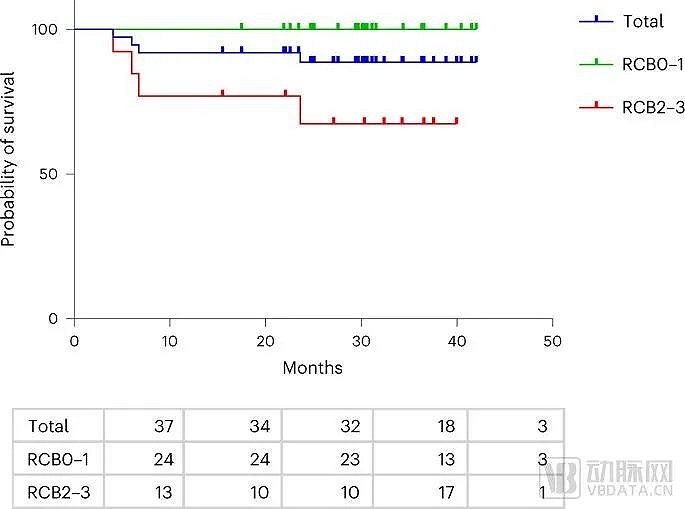
今年,溶瘤病毒T-VEC(Imlygic)聯合化療藥物蒽環霉素和紫杉醇針對適應癥展現了積極臨床2期結果,讓市場對T-VEC有了新的期待:37名三陰性乳腺癌患者在手術前接受T-VEC溶瘤病毒聯合化標準化療,89%患者2年內未復發堪稱亮眼,且安全性與標準化療沒有顯著差異。這再次表明腫瘤內存在強大的免疫激活,T-VEC結合目前的化學免疫療法治療三陰性乳腺癌是有必要的。
聯合化療之外,在溶瘤病毒的臨床研究中,全球有超過一半的研究設計為溶瘤病毒聯合免疫抑制劑,但想要達到理想的聯用療效并不容易,例如今年破產的Oncorus正是在核心管線和K藥聯用試驗失敗后,走向了下坡路。
T-VEC也曾開啟與K藥的聯用臨床試驗,并獲得了前期突破性療效數據,但是,后期擴大樣本研究在2021年ESMO大會上的報告顯示,該項研究的3期臨床試驗并未達到主要終點。
2019年,韓國的一家Biotech企業SillaJen也宣布,其溶瘤病毒藥物JX-594聯合小分子藥物索拉菲尼治療肝細胞癌的3期臨床,因獨立數據評估委員會評估無法達到臨床終點而提前終止。
這些聯合療法從理論上講都非常具有前景,但是缺乏“系統”的概念。PD-1抗體與Imlygic聯用時,如果同時給藥,可能會由于沒有協調好抗原遞呈細胞及腫瘤殺傷細胞等系列抗腫瘤免疫機制,而無法做到“三峰重疊”,導致聯合療效無法體現;索拉菲尼與溶瘤痘苗病毒藥物聯用時,其在一定程度上可能破壞了溶瘤痘苗病毒在腫瘤細胞內的復制基礎,導致病毒無法在腫瘤中大量增殖,釋放全息抗原,保證不了“三道的暢通”。
康萬達總經理蔡金露博士表示,大藥企的臨床試驗設計是經過精細考量的,其挫折可以給之后的研究更多啟示,以提高成功幾率。例如,康萬達最具代表性的核心產品溶瘤痘苗病毒TT3,利用生物信息大數據篩選取得非人源的靶點,設計制導型溶瘤病毒,有效標記腫瘤細胞,聯合精準藥物/療法(如CAR-T、ADC等)實現對被標記腫瘤細胞的殺傷,達成“里應外合”的抗腫瘤治療效果。
對于聯合治療設計的探索,蔡金露博士總結了幾點:
1)選擇合適的聯合對象。例如痘苗病毒和抗體類或細胞治療聯用效果好,或腺病毒和放療聯合效果佳。
2)優化給藥順序和時間間隔。溶瘤病毒應先行給藥,且時間上要保證協同作用。
3)匹配給藥劑量。充分發掘單藥和聯合用藥的最佳劑量,不能簡單疊加。
4)動態調整方案。在試驗過程中跟蹤數據、評估效果,必要時改進給藥方案設計。
也有公司在嘗試做新的聯用,例如復諾健提出聯合溶瘤病毒與mRNA疫苗,利用mRNA疫苗建立外周的系統抗腫瘤免疫,同時采用溶瘤病毒打破瘤內免疫抑制,改善腫瘤微環境。一方面讓mRNA疫苗的抗腫瘤免疫活性能夠更好在瘤內發揮作用,另一方面通過腫瘤細胞的裂解暴露更多的腫瘤抗原,從而強化腫瘤免疫的效果。目前復諾健已構建多個mRNA腫瘤疫苗。
等待溶瘤病毒界的DS-8201?
聯合療法的研究和應用潛力巨大,但仍需一個“爆款”誕生。有業界人士提出:“溶瘤病毒與免疫療法聯合的多通道探索是重要課題。聯用給藥順序、給藥劑量等都會影響溶瘤病毒藥效,需要大量的臨床前和臨床研究來證實。當然,第一步是溶瘤病毒要跑出單藥。”
溶瘤病毒的境遇或許和此前的ADC有相似之處,全球第一個ADC藥物Mylotarg用于治療急性粒細胞白血病,但因嚴重肝毒性反應和無明顯生存獲益,于2010年遺憾退市。之后也有不少ADC藥物紛紛折戟,ADC藥物陷入過很長一段時間的低谷期。
第一三共的DS-8201橫空出世徹底顛覆了ADC領域,但在DS-8201以驚艷結果亮相之前打磨了良久,在毒素、偶聯方式、連接、DAR、旁殺效應模塊進行了海量研究和實驗,也打破了很多ADC領域原有的認知。
例如第一三共認為毒素分子也不一定需要pM級別的活性水平,而是可以通過一個單抗上連接多個毒素分子和旁觀者效應進行效果彌補,這使得小分子毒素的選擇范圍可以在nM活性水平,而不用艱難地尋找高活性小分子毒素,這一創新給ADC領域后續的發展打開了局面。
溶瘤病毒領域曾經迎來過一段高光,2015年后伴隨著FDA批準的第一款溶瘤病毒療法上市,各家MNC開始在這一賽道競相布局:2016年BMS以9.36億美元獲得Psioxus Therapeutics開發的NG-348的全球商業許可;2018年2月默沙東3.94億美元收購Viralytics;2018年5月強生以10.4億美元收購BeneVir。
可隨著幾年來都缺乏振奮人心的新研究成果,且上市產品Imlygic的銷售額平平,MNC逐漸將注意力轉移出了溶瘤病毒領域。
相比ADC,溶瘤病毒顯然更加復雜,但出色的單藥并非溶瘤病毒領域難以逾越的問題。
“單藥獲批上市不一定要十分驚天動地的成果,也可以是解決部分患者臨床需求,優先獲批的單藥適應癥可以成為后續探索創新聯合治療方案的基石。即使是PD-1抗體,在最開始獲批時也是從小范圍的適應癥做起的。”蔡金露博士對此表示,“接下來的趨勢之一,是可以利用免疫組學和基因組學等數字化手段進行個體的方案設計,選擇對特定溶瘤病毒敏感性高的適宜人群,可大幅提高溶瘤病毒療法的精確度與效果。”
以國內溶瘤病毒研發熱度,中國公司有望在這一領域搶得先機。此外,中國監管全球領先:FDA還未有針對溶瘤病毒的指南,CDE已先行一步。2021年2月,為指導和規范溶痛病毒類藥物臨床試驗設計,CDE頒布《溶瘤病毒類藥物臨床試驗設計指導原則(試行)》。今年2月,為規范和指導溶瘤病毒產品的藥學研發、生產和注冊,CDE頒布《溶瘤病毒產品藥學研究與評價技術指導原則(試行)》。
另外,國內基因工程技術是溶瘤病毒領域發展的重要基礎。例如科創板首家CGT CDMO和元生物就是以溶瘤病毒和基因治療載體為主要業務,其溶瘤病毒大規模生產技術在行業內處于領先地位,并采用新的檢測技術用于管控監測之前無法檢測的風險。
“溶瘤病毒的研發的確經歷了挺長一段時間的沉默,但近年來先是G47Δ在日本獲批上市、RP1公布I期臨床結果時公司股票大漲、CG0070也獲得了很不錯的3期中期數據。越來越多的證據在證明溶瘤病毒的優越性。”濱會生物創始人劉濱磊博士此前接受采訪時提到。
業界認為,伴隨著賽道內企業在溶瘤病毒聯合療法、靜脈給藥等方面的不斷創新和突破,溶瘤病毒療法出現下一個“爆款”并不是完全沒有可能性。只是在這個前沿領域,探索和失敗是共生的,而有科學價值與啟發意義的新藥研究,應是被尊重的,而不是因為創新性而在當下環境中被“敬而遠之”。



