文|氨基觀察 黃愷
雖然在全球創(chuàng)新藥領(lǐng)域,國內(nèi)藥企起步并不早,目前尚處于追趕階段,但一個不可否認(rèn)的事實是,它們的站位正越來越居前。
這一點,在諸多療法領(lǐng)域已經(jīng)得到了充分的證明。典型如ADC浪潮下,國內(nèi)藥企依靠工程師等綜合優(yōu)勢,占據(jù)上風(fēng)。
不僅是ADC,在細(xì)胞療法領(lǐng)域,國內(nèi)藥企也處于領(lǐng)先身位。例如,在CAR-T療法的紅斑狼瘡適應(yīng)癥的探索中,許多國內(nèi)選手的研發(fā)進度跑到了海外大藥企的前面。
那么,在這場遲遲未能被攻克的疾病領(lǐng)域,率先突圍的會是中國藥企嗎?
01 尚無根治療法的窘境

作為一種自身免疫系統(tǒng)帶來的疾病,紅斑狼瘡是實實在在的“存在巨大未滿足臨床需求”領(lǐng)域。
從發(fā)病機制來看,其誘因是患者的血清中存在多種自身抗體,并結(jié)合自身抗原形成抗原抗體免疫復(fù)合物,沉積在不同組織并引起相應(yīng)的免疫反應(yīng),造成多系統(tǒng)損傷。

紅斑狼瘡最具特征的癥狀是面頰部出現(xiàn)蝶形紅斑,而“狼瘡”的名字正是因為過去人們認(rèn)為該病的面部紅斑表現(xiàn),像是被狼咬傷所致。而除了皮膚損害,紅斑狼瘡的病變還可累及多臟器和系統(tǒng)。
這也導(dǎo)致,患者會隨著患病周期加長而處于病情加速惡化的處境。目前,患者的10年生存率雖已升至目前的97%,但25-30年后的存活率呈斷崖式下降,僅為30%。因此,紅斑狼瘡患者存在著極強的治療需求和迫切的治愈意愿。
但遺憾的是,現(xiàn)有治療藥物,均無法起到根治的效果,只能是起到短期控制疾病活動的作用。
在無治愈療法的情況下,當(dāng)前常用糖皮質(zhì)激素、抗瘧藥、免疫抑制劑和生物制劑等進行紅斑狼瘡的治療。而這些療法無一例外,效果欠佳且存在副作用較高的bug。
如下圖所示,糖皮質(zhì)激素是治療紅斑狼瘡的基礎(chǔ)用藥,以激素為基礎(chǔ)的傳統(tǒng)療法仍存在反應(yīng)率不足、復(fù)發(fā)風(fēng)險高、副作用明顯等問題。

總的來說,紅斑狼瘡藥物的研發(fā)方向極為確定。
其中,治療的短期目標(biāo)是控制疾病活動、改善臨床癥狀、達(dá)到臨床緩解或可能達(dá)到的最低疾病活動度;
長期目標(biāo),則主要為預(yù)防和減少復(fù)發(fā),減少藥物不良反應(yīng),預(yù)防和控制疾病所致的器官損害,實現(xiàn)病情長期持續(xù)緩解,降低患者病死率,提高患者的生活質(zhì)量。
盡管方向明確,但紅斑狼瘡藥物的研發(fā)并不容易。
02 需要翻越的兩座大山
對于紅斑狼瘡藥物的研發(fā)來說,核心困境是兩座大山難以翻越:發(fā)病機制和臨床設(shè)計。
發(fā)病機制方面,該病的病因至今尚未確定。
雖然我們能夠發(fā)現(xiàn),自身免疫系統(tǒng)的過度激活,導(dǎo)致了紅斑狼瘡的存在。但,又是什么因素導(dǎo)致自身免疫系統(tǒng)的過度激活,尚無定論。
當(dāng)前,學(xué)術(shù)界普遍認(rèn)為遺傳、內(nèi)分泌、感染和環(huán)境等因素均與發(fā)病有關(guān)。研究仍在繼續(xù),目前甚至有人正在研究齲齒與紅斑狼瘡之間的關(guān)系。
因此,我們要想明確免疫系統(tǒng)激活驅(qū)動因素,進而達(dá)到對癥治療,預(yù)防臨床疾病的發(fā)生仍不現(xiàn)實。
除了機制不明這一因素,“煉獄”級別的臨床難度,也是阻礙新療法面世的因素之一。
因為疾病的特殊性,不同的人群、適應(yīng)癥以及藥物給藥劑量的設(shè)定,都會直接影響臨床的成敗。
由于紅斑狼瘡具有高度“變異性”,不同的患者會有各自不同的癥狀。在此前紅斑狼瘡新藥研發(fā)的過程中,臨床評價環(huán)節(jié)成了眾多候選藥物難以翻越的一座大山。
另外,因為紅斑狼瘡病情多不穩(wěn)定、變化快,醫(yī)生在治療時尤為謹(jǐn)慎。出于安全性考慮,采用什么劑量、多久給一次藥,都是有待解決的難題。
諸多因素導(dǎo)致,紅斑狼瘡堪稱創(chuàng)新藥研發(fā)黑洞。截至目前,上市的有效藥物寥寥無幾。
03 加速向前的攻堅戰(zhàn)
當(dāng)然,我們對于紅斑狼瘡的攻堅戰(zhàn),并非一無所獲。
即便對于最終驅(qū)動免疫系統(tǒng)過度激活的因素尚不得知,但基于對免疫系統(tǒng)細(xì)胞、介質(zhì)和途徑對狼瘡發(fā)病機制的了解,具有靶向性的生物藥開始走向臺前。
截至目前,全球有多款大分子藥物上市,包括葛蘭素史克的貝利尤單抗、榮昌生物的泰它西普、阿斯利康的阿伏利尤單抗等。
相比于傳統(tǒng)藥物,靶向性藥物由于能夠高特異性結(jié)合靶點,減少全身性副作用發(fā)生,提
高治療窗口從而提升療效和安全性。因此,上市已久的貝利尤單抗早就邁入重磅炸彈行列,2021年上市的伏利尤單抗也同樣快速放量,今年前三季度銷售額接近2億美金。
與此同時,包括JAK抑制劑、CD20單抗等諸多創(chuàng)新療法,均已進入注冊臨床階段。不遠(yuǎn)的將來,我們將會迎來更多紅斑狼瘡的新療法。
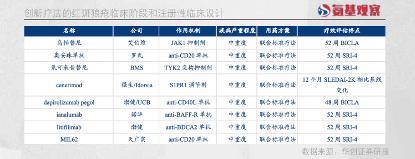
當(dāng)然,這些藥物都還不是勝利的終點。
當(dāng)前已經(jīng)上市的靶向藥物,臨床定位主要是此前療法的補充,主要應(yīng)用場景,是對難治性(經(jīng)常規(guī)治療效果不佳)或復(fù)發(fā)性紅斑狼瘡患者在標(biāo)準(zhǔn)療法的基礎(chǔ)上起到改善作用。
從臨床設(shè)計來看也是如此。根據(jù)現(xiàn)有上市的大分子藥物,臨床主要納入的患者群體為中重度SLE患者,治療時需聯(lián)合標(biāo)準(zhǔn)療法。

并且,療效評估指標(biāo)多為SRI-4或BICLA,僅反映了用藥后相比基線患者疾病活動的改善,而未衡量“治愈或接近治愈”的指標(biāo),例如達(dá)到DORIS(系統(tǒng)性紅斑狼瘡緩解定義工作組)緩解或LLDAS(低疾病活動度)的患者比例。

這是因為,相比DORIS緩解或者LLDAS,當(dāng)前臨床設(shè)置的主要終點都更容易達(dá)到。以貝利尤單抗為例,回顧性分析結(jié)果顯示,BLISS-52和BLISS-76兩項臨床中,DORIS緩解的比例僅為5-6%,LLDAS達(dá)標(biāo)率也僅為12-15%。
實際上,上述提到的多款處于研發(fā)后期階段的生物制劑或靶向小分子藥物,定位也是緩解疾病活動,而并非“無藥物完全緩解”的狀態(tài)。
很顯然,這場攻堅戰(zhàn)能要繼續(xù)向前。
04 CAR-T療法會是最終答案嗎?
或許,CAR-T療法能給我們帶來更大驚喜。
從機制來看,系統(tǒng)性紅斑狼瘡的發(fā)病和進展和B細(xì)胞密切相關(guān),因此靶向B細(xì)胞的療法一直是研發(fā)的重要方向。
此前靶向B細(xì)胞的療法,由于無法徹底清除B細(xì)胞或無法完全抑制B細(xì)胞活性等因素導(dǎo)致,難以達(dá)到治愈的結(jié)果,而CAR-T療法則具有這一可能。
CAR-T療法能夠通過表達(dá)CD19 CAR特異性殺傷B細(xì)胞,或通過表達(dá)BCMA CAR特異性殺傷B細(xì)胞分化而來的漿細(xì)胞,從而有望達(dá)到深度清除紅斑狼瘡致病性B細(xì)胞的效果,觸發(fā)免疫“重置(reset)”,完全緩解紅斑狼瘡疾病。

隨著美國田納西州大學(xué)健康科學(xué)中心的科學(xué)家,于2019 年在小鼠模型中驗證了這一可能之后,CAR-T療法應(yīng)用于紅斑狼瘡治療的研究邁入快車道。
ASH 2023年會上,Georg Schett 團隊更新的研究數(shù)據(jù)顯示出良好的效果。8例紅斑狼瘡患者在接受治療3個月后達(dá)到完全緩解,此后SLEDAI維持0分。5例隨訪14-24個月的紅斑狼瘡患者B細(xì)胞已經(jīng)重建,病情仍維持緩解。
不僅是海外研究,中山市人民醫(yī)院研究團隊也展開了類似的研究,得出的結(jié)論也是一致:CAR-T療法治療紅斑狼瘡有望安全高效達(dá)到一次性治愈。
這無疑是紅斑狼瘡患者新的希望。當(dāng)然,結(jié)論是否正確還有待藥企們繼續(xù)攻堅。截至目前,包括諾華等全球多家企業(yè)均入局了CAR-T療法在紅斑狼瘡領(lǐng)域的探索。

其中,國內(nèi)藥企為中堅力量。如上圖所示,包括馴鹿生物、百暨基因、藥明巨諾、合源生物等均有所布局,不管是布局?jǐn)?shù)量還是進度層面,國內(nèi)藥企都處于領(lǐng)先身位。
那么,國內(nèi)藥企會率先脫穎而出嗎?讓我們拭目以待。



