文|動脈網
近期,一則高達1億美金的種子輪融資消息在行業里被刷屏,成為截至目前,今年醫療領域最大一筆種子輪融資。
眾所周知,在創投行業,種子輪是創業公司獲得的第一筆重要資金,由于此時項目十分初創,平均融資額往往在數十萬至數百萬美金之間,鮮有企業能拿到數千萬,甚至上億美金。
“如果一家剛運營的項目能拿到上億的大額融資,一般都是背后的創業團隊極其牛,且項目發力的方向是大熱門,二者往往缺一不可。”行業投資人龔莫告訴動脈網。
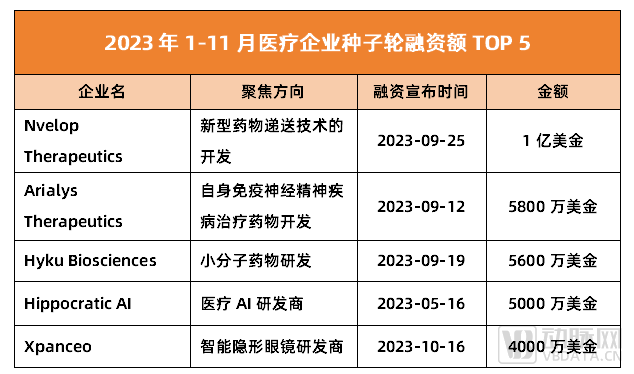
數據來源:動脈橙數據庫
此次拿下1億美金種子輪的企業名為Nvelop Therapeutics,成立時間僅1年。該企業背后的創始人為哈佛大學教授、基因編輯先驅劉如謙(David Liu):其除了是學術大牛外,亦擁有豐富的創業經驗,主導或參與了Prime Medicine、Editas Medicine、Chroma Medicine、Exo Therapeutics等多家知名企業的創辦。其中,Prime Medicine、Editas Medicine等已成功IPO。

而在業務方向上,Nvelop Therapeutics主要聚焦于新型遞送技術的開發,這一領域目前正是醫療行業的大熱門。根據動脈橙數據庫顯示,這一年多以來,藥物遞送賽道共有超10起融資事件,總融資金額逾30億元。背后資方包括高瓴創投、MPM Capita、磐霖資本、泰煜投資、夏爾巴投資、險峰旗云、源碼資本等一眾知名機構。
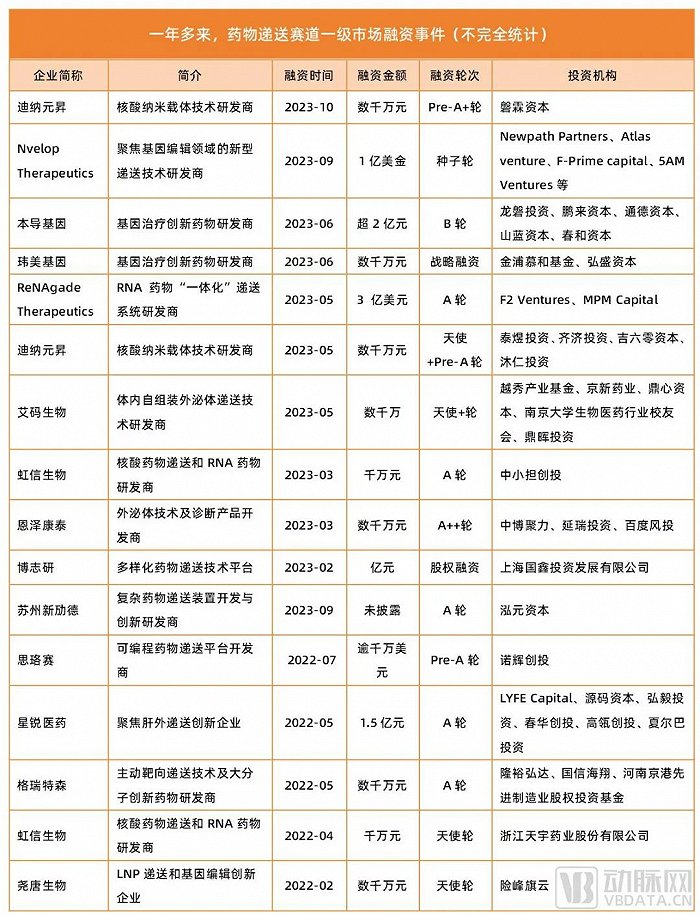
數據來源:動脈橙數據庫
頻獲融資背后,藥物遞送賽道正在講述怎樣的新故事?
拿下今年最大醫療種子輪融資,Nvelop Therapeutics憑什么?
在醫藥研發領域,藥物遞送被行業普遍認為是新一代技術的主力戰場。
“藥物遞送在臨床中極其重要。一是因為它會影響藥物最終發揮藥效的作用大小,二是決定了藥物研發成敗的關鍵點。”行業投資人龔莫告訴動脈網,藥物遞送系統往往承載著“藥物靶向”、“藥物控釋”、“促進藥物吸收”、“增強藥物屬性”四大核心功能,在產業鏈中價值巨大。
正是基于此,藥物遞送受到了行業的廣泛關注。而身處這一熱門賽道,加之創始人的豐富背景,Nvelop Therapeutics一誕生便具有明星光環:該企業以期通過切入遞送技術領域,來釋放基因治療的更大潛力。
要知道,在基因編輯領域,由于細胞膜的特殊性質和治療性基因材料的復雜性,基因編輯藥物在人體內并不穩定,所以一旦藥物靶向錯誤靶標,很容易對人造成嚴重的副作用。因此,如何將基因編輯藥物遞送至合適的位置,一直是行業最為關心的問題之一。
在這一方向上,Nvelop Therapeutics的創始人劉如謙進行了多年研究,其于2022年1月與合作者在《Cell》期刊上發表了論文《Engineered virus-like particles for efficient in vivo delivery of therapeutic proteins》。論文提到,目前在臨床應用上,主要有病毒載體(慢病毒、AAV等)和非病毒載體(LNP等)兩種,但這些載體尚有諸多不足,以AAV為例,其就具有裝載能力有限(僅為5KB的DNA)的缺點。
針對此,劉如謙與團隊開發出一種工程化類病毒顆粒(eVLP),其能夠高效地將基因編輯工具遞送到動物體內的細胞中。eVLP具有不少亮點,比如論文表示,eVLP遞送的堿基編輯對小鼠肝臟63%的細胞進行了有效編輯,成功將血清中PCSK9水平降低了78%。
此外,研究團隊在對eVLP遞送的體外和體內基因編輯的DNA水平和RNA水平脫靶情況進行檢測后發現,無論是DNA還是RNA,都未檢測到脫靶,而這與AAV病毒或質粒載體遞送相比,優勢明顯。
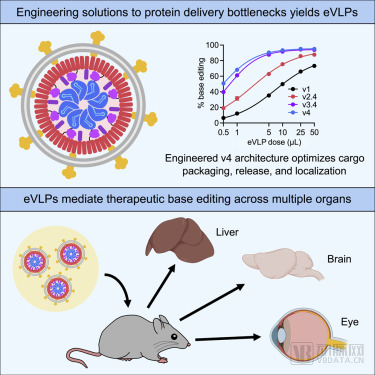
eVLP解決方案示意圖 圖源:《Cell》
Nvelop Therapeutics正是以上述研究為基礎而成立的公司,而1億美金的投資,足以表明投資機構們對eVLP應用潛力的認可。
在團隊組成方面,除了劉如謙外,哈佛大學教授J. Keith Joung擔任聯合創始人,后者亦是基因編輯公司Editas Medicine、Beam Therapeutic、Pairwise Plants的聯合創始人。其中,擔任CTO的是Jeffrey Hrkach博士,其曾在生物制藥公司Moderna和Frequency負責遞送研究。可見,明星管理團隊的加持是Nvelop Therapeutics能夠迅速起勢的原因所在。
據LinkedIn顯示,Nvelop Therapeutics正在持續擴招,目前已招募數十位員工,他們主要來自疫苗、細胞療法和基因治療等多個細分領域,團隊具有多學科交叉的復合產業背景。
綜上,正是身處藥物遞送賽道、擁有前沿的遞送解決方案與明星創始團隊陣容三大要素的匯集,使得Nvelop Therapeutics在成立僅一年多時間里,便拿下1億美金大額種子輪融資。
掀起資本熱潮,藥物遞送賽道進展幾何?
在一年多時間里,投資機構們砸下超30億元的資金,開啟了新一輪藥物遞送賽道融資熱潮。
“無論是基因治療,還是小分子藥、大分子藥,其實都離不開遞送技術。”行業投資人龔莫表示,從體外微針注射遞送小分子化學藥劑,再到用脂質體(LNP)包裹大分子藥物體內遞送,遞送系統可謂無處不在。
但同時,藥物遞送賽道投資并不容易。“投資藥物遞送賽道需要理清一系列關鍵問題。每種載體技術都各有特點,那理想的遞送載體究竟需要具備哪些屬性?如何辨別各自的商業化前景?”在龔莫看來,藥物遞送系統要觀察兩個基本面,一是在技術與臨床角度,裝載能力、靶向遷移能力與安全性是否優秀,二是在生產制備角度,是否可以規模化發展。
因此,把握好技術流向與商業價值判定具有重要意義。
在技術流向上,籠統地來說,藥物遞送系統可以分為體外遞送和體內遞送兩大類。其中,體外遞送包括微針、貼片等。目前,一級市場相對關注更多的是體內遞送。
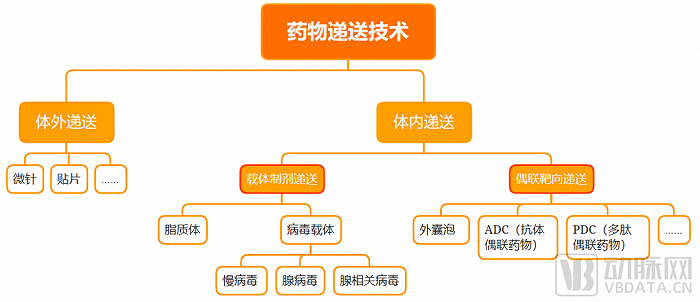
藥物遞送技術分類 動脈網制圖
將體內遞送再往下拆分,主要可歸納為載體制劑遞送、偶聯靶向遞送兩個方向:載體制劑遞送是指需要通過獨立載體進行包裝后進行的藥物遞送,偶聯靶向遞送則是將靶向分子與藥物分子通過化學鍵偶聯起來形成創新藥。
“不同的遞送技術,往往有與之最契合的藥物。”行業投資人龔莫表示,對技術的運用要與臨床場景相掛鉤。
正是基于此,體內遞送領域正“百花齊放”,新舊載體都有其發揮作用的舞臺空間。
具體來看,載體制劑遞送這一方向目前有脂質體(LNP)、病毒載體、外囊泡(EVs)等主流遞送載體。
作為通用的納米載體平臺,脂質體可以運輸疏水或親水分子,包括小分子、蛋白質和核酸。目前,脂質體制劑已被批準用作藥物和疫苗提供抗癌、抗炎、抗生素、抗真菌、麻醉劑以及其他藥物和基因療法。
除此之外,近年來脂質體(LNP)在mRNA疫苗遞送上也受到了更多重視。原因在于,脂質體是球形囊泡,其可將mRNA包裹在內,從而抵御核酸酶的作用,以及脂質體類似于細胞膜,易與受體細胞融合,所以轉染效率高。
以今年3月完成A輪融資的企業虹信生物為例,其就在脂質納米粒(LNP)遞送領域深耕,現已申請數十項發明專利,包括多項PCT和歐美發明專利,且已擁有完全自主知識產權的可離子化氨基脂質庫。針對核心的可離子化氨基脂質,虹信生物完成了全球的專利布局,這為其mRNA創新藥物管線開發以及對外授權合作開發奠定了基礎。
又比如今年5月獲得3億美元A輪融資的ReNAgade Therapeutics。該企業在其全RNA系統中結合了包括新型脂質納米顆粒(LNP)在內的遞送技術,以期將RNA藥物遞送到以前無法進入的體內組織和細胞,從而消除RNA療法的主要局限性。據STAT報道,ReNAgade Therapeutics的管線已完成體外與小鼠實驗,并在進行多項非人靈長類的臨床前實驗。
病毒載體是最早被開發的生物藥遞送技術之一,并在細胞和基因治療產業快速興起的當下被人們所熱議。
時下,慢病毒(LV)、腺病毒(ADV)和腺相關病毒(AAV)三個領域最受關注。其中,慢病毒(LV)是應用最為成熟的病毒載體類型,特別是在免疫細胞治療(如CAR-T療法)上起到了關鍵作用;而腺病毒(ADV)主要應用在疫苗領域;腺相關病毒(AAV)被更多應用于臨床上的體內外基因治療。
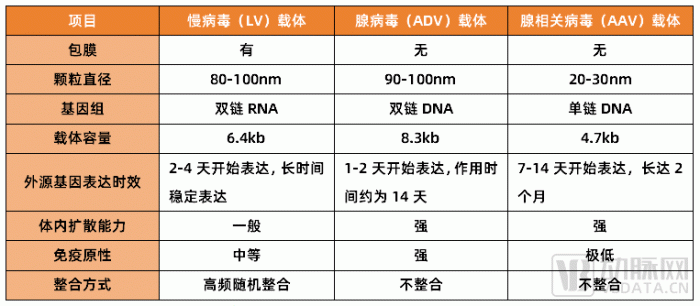
三種常用病毒載體特點對比 動脈網制圖
目前,國內已經有不少企業在病毒載體方向布局,各個板塊發展迅速,比如慢病毒(LV)的研發設計、加工生產就形成了比較明確的SOP(標準作業程序)體系,并向外延伸,促成了細胞治療CDMO產業的快速興起,機會十分廣闊。
在這一方向上,已有多家企業拿下融資。比如今年6月完成超2億元B輪融資的本導基因就搭建了自己的下一代慢病毒載體平臺(BDlenti)。圍繞著核心遞送技術平臺,本導基因布局了多條first-in-class的產品管線,開展了多項first-in-human臨床研究,并與國際著名藥企開展了重大神經系統疾病新型療法的合作研發。
同月獲得數千萬元融資的瑋美基因則建立了全面的腺相關病毒 AAV 改造平臺——AAVMeta。據悉,該企業首款眼科新型 AAV載體已成功實現商業轉化,并借助載體開發的藥物已進入臨床實驗階段。與此同時,瑋美基因還成功開發了用于耳蝸、肺部、神經系統和肌肉等多種不同組線的新型 AAV 載體,并在國內外的基因治療疾病領域展開了廣泛的專利布局。
外囊泡(EVs)為天然的生物大分子載體,其能像投遞包裹一樣將生物大分子從一個細胞傳遞到另一個細胞里面,進而實現細胞間溝通。
作為藥物遞送載體,外囊泡(EVs)具有不錯優勢,包括多重載藥能力、良好的組織和血腦屏障透過性、表面容易裝飾等。而根據不同的大小、合成方式、生物學性質,外囊泡(EVs)又分為多種不同的亞型,例如外泌體、微粒/微囊泡、腫瘤小泡、凋亡小體等。
比如今年3月拿下數千萬元A++輪融資的恩澤康泰,該企業基于其旗下核心知識產權的工程化外泌體平臺Echosome 來幫助外泌體創新藥研發,現已建成3000平米外泌體GMP中試車間,并且建立成熟的外泌體生產工藝和質量表征體系,可提供工程化外泌體載體設計開發和工程化外泌體的CDMO服務等。
又比如2022年7月完成逾千萬美元Pre-A輪融資的思珞賽,其對外泌體載藥技術進行了創新性研發,獨立開發了程序化藥物遞送系統(Programmable Drug Delivery)——TAXYTM。此外,該企業還開發了外泌體藥物裝載系統ExoPack,能將蛋白或核酸藥物高效且具有選擇性地裝載到外泌體的內部或者表面。
再看偶聯靶向遞送。從偶聯技術的維度來說,主要有隨機偶聯和定點偶聯兩種類型,二者都是用一個Linker(連接子)將藥物和具備靶向遞送功能的分子相連接,形成具有靶向遞送功能的偶聯藥物。只是相對來說,定點偶聯技術獲得的產物均一性高,以及可降低雜質帶來的毒性和不穩定性。
在這一方向,常見的有ADC(抗體偶聯藥物)、PDC(多肽偶聯藥物),其他主要為ABC(抗體生物聚合物偶聯物)、ACC(抗體細胞偶聯藥物)、AOC(抗體寡核苷酸偶聯物)、FDC(抗體片段偶聯藥物)、ISAC(抗體免疫刺激偶聯物)、VDC(病毒樣藥物偶聯物)等偶聯藥物。
其中,ADC當下受到的關注最多。就在10月20日-24日于西班牙馬德里舉行的“2023年歐洲腫瘤內科學會(ESMO)”上,ADC成為行業熱議話題。20日當天,知名藥企默沙東與第一三共就三種ADC達成40億美元合作,默沙東為其中的一款藥物——R-DXd預付了7.5億美元。未來,默沙東預計還將支付165億美元的商業化里程碑款項,合作總額或高達220億美元。這足以體現偶聯靶向遞送方向具有不錯的商業合作空間。
不難發現,無論選擇哪一個藥物遞送路徑,核心是要能推動藥物成功用于疾病治療,并提高藥物臨床療效和降低藥物毒性等。這樣的藥物遞送系統才是有價值,且被投資者所認可的。
向未來進發,行業的挑戰與新可能
自現代醫藥研發發軔以來,藥物遞送系統的研究便是貫穿其中且始終不變的熱點話題。特別是在近年,隨著生物藥崛起,行業對藥物遞送技術的需求也越來越多。
在此背景下,多位投資人告訴動脈網,受益于基因療法、RNA療法等新技術的快速發展,藥物遞送載體的潛在市場被持續看好。而這,也將帶動行業參與者在一級市場成為矚目的焦點,以及在二級市場講出更為性感的故事。
“載體本身不一定只是一種遞送工具,它也有可能成為或誕生一種創新的療法。這也是載體平臺的魅力所在。此外,載體技術除了本身是新療法的樞紐技術外,更重要的是其商業模式的靈活性。我們投資的公司將不再是把所有希望都賭注在單一靶點的成功與否,而是可以開創多種、多面向的合作,快速且不斷地將不同疾病領域的療法推進臨床。”比鄰星創投合伙人宋豪麟此前告訴動脈網。
大發展的背后,行業依然存在著不少挑戰。比如外泌體的純化就頗為復雜,加之哺乳動物細胞釋放的外泌體數量相對較低,所以要如何獲得高產量的純外泌體,是入局者們要攻克的重點問題。
又比如腺相關病毒(AAV)的研發外包產業正處于起步期,行業內尚未有明確的共識,因此如何完善腺相關病毒(AAV)載體的GMP生產,仍是眾多基因治療企業需關注的關鍵要素。
當然,挑戰即是機遇,當行業參與者們解決了一個又一個挑戰,未來更多且更為高效、完美的遞送系統必會應運而生,從而助推生物醫藥的高質量發展。
在行業的潮起之中,中國藥物遞送領域的領軍企業也勢必會在接下來的一段時間里成批涌現。
參考資料:
1:Engineered virus-like particles for efficient in vivo delivery of therapeutic proteins. 《Cell》
官網地址:https://www.cell.com/cell/fulltext/S0092-8674(21)01484-7
2:《默沙東(MRK.US)與第一三共合作開發三款ADC》 智通財經



